La frataxine est un acteur majeur de l'homéostasie du fer et de la maturation des protéines fer-soufre qui jouent un rôle essentiel pour la vie cellulaire. Certaines mutations de la protéine sont associées à des maladies neurogénératives comme l'ataxie de Friedreich. Cependant sa fonction précise est encore controversée, même si sa grande affinité pour le fer suggère qu'elle est un donneur spécifique d'atomes de fer pour l'assemblage des centres fer-soufre au sein d'une chaine polypeptidique.
Le laboratoire de Chimie Biologie (actuellement laboratoire Chimie et Biologie des Métaux) a isolé et caractérisé la frataxine bactérienne (le produit du gène CyaY). Les chercheurs ont également montré que cette protéine était associée sous forme de complexe stable à un autre acteur important du métabolisme des centres fer-soufre, à savoir la cystéine désulfurase IscS dont la fonction est de fixer le soufre de la cystéine (qui est donc convertie en alanine).
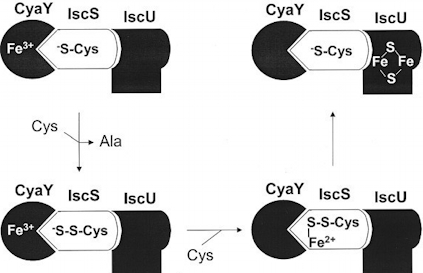
Pour la première fois l'assemblage correct d'un centre fer-soufre dans une protéine (IscU) est éffectué in vitro en utilisant une cysteine désulfurase (IscS) comme donneur d'atomes de soufre et un transporteur protéique de fer (CyaY) comme donneur d'atomes de fer.
Ces résultats confortent l'hypothèse selon laquelle la frataxine est une source contrôlée de fer pour la biosynthèse des clusters fer-soufre.