Les espèces réactives de l’oxygène (ERO) sont impliquées dans les processus de vieillissement et dans certaines pathologies comme les cancers, les maladies cardio-vasculaires, les inflammations et les maladies neurodégénératives. Il est important d’identifier leurs cibles et les moyens de défense des cellules. Dans cette optique, il faut pouvoir déterminer à quelle vitesse réagissent les ERO avec leurs cibles ou avec les protéines de défense et aussi identifier leurs mécanismes d’action.
Les ERO comme le superoxyde (O2•-), le peroxyde d’hydrogène (H2O2) et le radical hydroxyle (HO•) sont produites au sein des cellules (Figure 1) lorsque la réduction de l’oxygène en eau pendant la respiration n’est pas complète. Ces espèces sont des oxydants puissants qui peuvent endommager les protéines, les acides nucléiques (ADN et ARN) et les membranes cellulaires. Au sein des protéines, leurs principales cibles sont les fonctions thiol des cystéines qui peuvent être facilement oxydées.
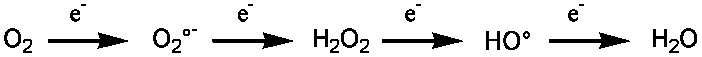
Figure 1 : L'oxygène est successivement réduit par quatre électrons pour donner de l'eau au cours de la respiration cellulaire. Les espèces réactives de l'oxygène sont les trois molécules représentées au milieu de cette réaction.
Chez l’homme, environ 10 % des protéines se lient à un ion Zn2+ grâce à quatre acides aminés cystéines (Cys) et histidines (His) pour acquérir leur structure et leur fonction (Figure 2) [1]. De par la présence des cystéines, ces sites métalliques, de formule Zn(Cys)4-x(His)x (x = 0, 1, 2), sont des cibles potentielles des ERO. L'oxydation des cystéines de ces sites provoquerait la libération du zinc et la déstructuration de la protéine.
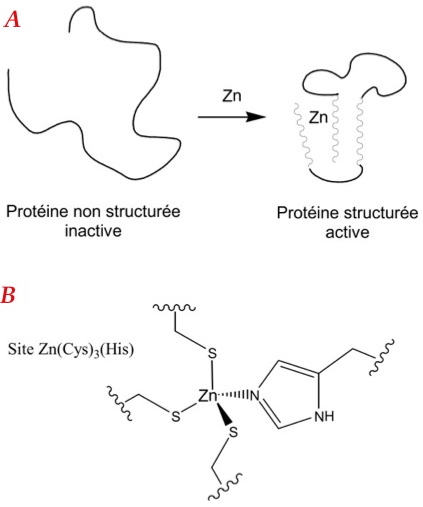
Figure 2 : A - Structuration d'une protéine en présence de zinc. B - Exemple de site Zn(Cys)4-x(His)x avec x = 1
L’oxydation des cystéines libres par les ERO participe à des processus de signalisation et au maintien de l’homéostasie rédox de la cellule. Elle a donné lieu à de nombreuses études [2]. Alors qu’on ne trouve quasiment aucune étude consacrée à la réactivité de ces protéines à zinc avec des ERO, il a longtemps été affirmé dans la littérature que le zinc protégeait les cystéines de l’oxydation au sein de ces sites. Cependant, cette assertion a été récemment remise en cause par la découverte de protéines de défense contre les ERO qui détectent ces espèces grâce à un site Zn(Cys)4-x(His)x. C’est par exemple le cas des protéines de défense Hsp33, RsrA, ChrR chez certaines bactéries. Chez l’homme, un rôle similaire a été proposé pour le site à zinc de la protéine Keap1.
Des chercheurs de notre laboratoire élaborent des modèles des sites Zn(Cys)4-x(His)x pour en étudier la réactivité avec les ERO. Ce sont des peptides composés d’un cycle de 8 à 12 acides aminés sur lequel est greffé une chaîne peptidique linéaire d’une dizaine d’acides aminés. Ces molécules sont conçues pour reproduire au mieux la structure autour du zinc et des cystéines. L’intérêt des modèles peptidiques réside dans leur taille réduite (environ 20 acides aminés) en comparaison de celle des protéines qu’ils modélisent (généralement plus de 150 acides aminés) (Figure 3). Celle-ci autorise des études spectroscopiques, cinétiques et mécanistiques beaucoup plus complètes et précises. Il est également aisé de synthétiser des mutants de ces peptides afin de déterminer les facteurs qui gouvernent leur réactivité.
Cette équipe a récemment décrit l’élaboration de deux modèles du site Zn(Cys)4 de la protéine Hsp33, chaperonne moléculaire qui détecte des ERO [4]. Les structures en solution de ces complexes modèles ont été déterminées par RMN. L’un d’eux (ZnL2) reproduit parfaitement la structure de Hsp33 autour du zinc (Figure 3) tant au niveau du repliement général de la chaîne peptidique que des liaisons hydrogène qui impliquent les soufres liés au métal. Le second modèle (ZnL1) ne se superpose pas aussi bien avec la structure de Hsp33. Les vitesses d’oxydation de ces modèles ont été mesurées et comparées aux données de la littérature pour Hsp33 : ZnL2, le modèle qui reproduit parfaitement le site Zn(Cys)4 de Hsp33, s’oxyde à la même vitesse que la protéine. L’autre peptide s’oxyde plus rapidement (le rapport des vitesses est de 1,5). Ceci montre que la réactivité du site est directement influencée par sa structure.
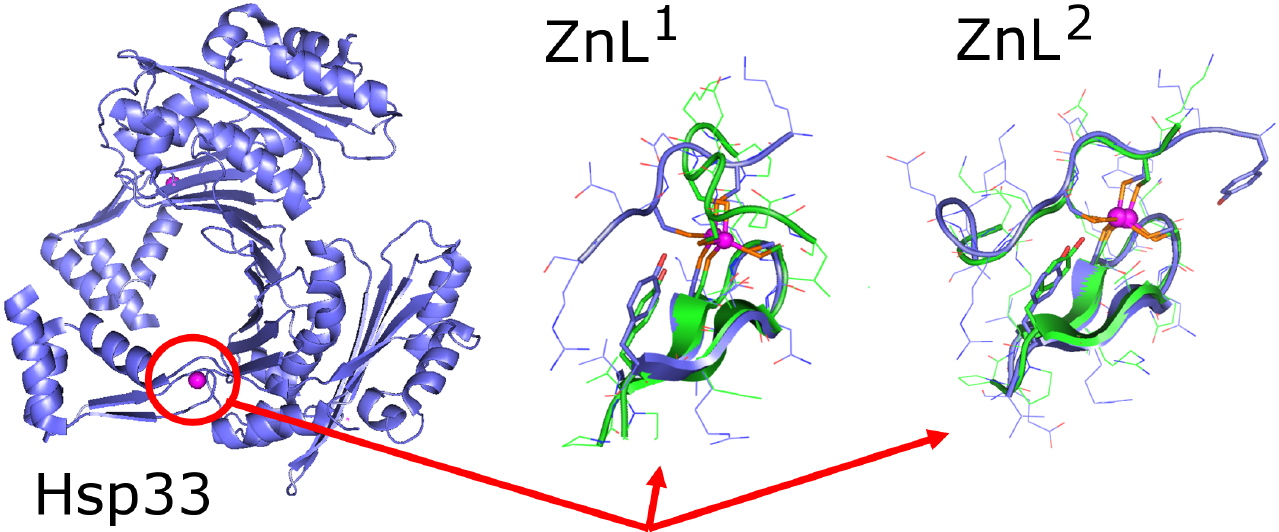
Figure 3 : La protéine Hsp33 [3] (dimère de 582 acides aminés) est représentée à gauche. Le cercle rouge montre le site à zinc (en rose) de la protéine et indique la zone reproduite par les modèles. Les structures des modèles ZnL1 et ZnL2 sont représentées en vert au milieu et à droite et sont superposé avec Hsp33 en bleu.
L’étude de ces modèles peptidiques permettra de déterminer les éléments qui gouvernent la réactivité de ces sites, en particulier les influences des liaisons hydrogène, de la charge du site et des acides aminés voisins des cystéines. Ces travaux donneront une image détaillée de la réactivité des protéines ayant un site Zn(Cys)4-x(His)x qui permettra aux biologistes de mieux appréhender le rôle de ces sites au niveau de la réponse cellulaire vis-à-vis des ERO.