Les hydrocarbures d’origine fossile sont la principale ressource énergétique dont dépendent l’essentiel des activités humaines, notamment l’agriculture, l’industrie et les transports. Leur utilisation massive a de lourdes conséquences en terme de pollution environnementale, car elle provoque une contamination généralisée de la planète par des composés toxiques, au premier rang desquels figurent les hydrocarbures aromatiques polycycliques (HAP). Les HAP constituent une famille de molécules constituées de 2 à 6 cycles aromatiques accolés. Il s’agit de molécules hydrophobes, résistantes à la biodégradation et redoutables en raison de leur caractère génotoxique. Quelques espèces bactériennes sont capables de dégrader ces polluants, les HAP de plus de quatre cycles étant les plus résistants à la biodégradation. Des chercheurs de notre laboratoire étudient les enzymes spécifiquement impliquées dans le catabolisme des HAP chez des bactéries appartenant aux genres Sphingomonas et Mycobacterium. Les travaux portent principalement sur des métalloenzymes de type dioxygénases qui catalysent l’attaque initiale des HAP. L’intérêt biotechnologique de ces enzymes est double : en jouant sur leur sélectivité et leur réactivité, l’efficacité de la biodégradation des HAP pourrait être augmentée. D’autre part, les dioxygénases sont remarquables car elles catalysent des réactions difficiles à réaliser en chimie de synthèse.
Une bactérie du genre Mycobacterium (souche 6PY1) capable de dégrader des HAP à 4 cycles comme le pyrène et le fluoranthène, a été isolée à partir d’un sol pollué. Par une approche protéomique, la plupart des enzymes impliquées dans la dégradation du pyrène ont été mises en évidence et trois métalloenzymes de type oxygénase (Pdo1, 2 et 3) ont été identifiées [5]. Grâce à l’analyse de l’expression de ces enzymes, ces chercheurs ont récemment démontré que leur régulation transcriptionnelle diffère en fonction du substrat de croissance, Pdo1 étant exprimée en culture sur benzoate ou sur HAP, alors que Pdo2 et Pdo3 ne sont exprimées qu’en présence de HAP.
L’étude de la sélectivité des oxygénases de la souche 6PY1, exprimées dans des souches recombinantes de Escherichia coli, a montré que les enzymes Pdo1 et Pdo3 ont une spécificité quasi identique pour les HAP à 3-4 cycles (pyrène et le fluoranthène), alors que l’enzyme Pdo2 attaque préférentiellement les HAP à 2-3 cycles comme le phénanthrène.
Une autre bactérie, du genre Sphingomonas, a été isolée pour son aptitude à dégrader un HAP à 4 cycles, le chrysène [6]. Des études protéomiques ont conduit à l’identification des gènes codant l’enzyme responsable de l’attaque initiale des HAP, une métalloenzyme de type dioxygénase [1].
Cette dioxygénase a été surproduite dans Escherichia coli et purifiée sous forme recombinante. L’enzyme oxyde 9 des 16 HAP jugés prioritaires par les agences de l’environnement, et son activité décroît en fonction du nombre de cycles du substrat. C’est la première enzyme capable d’oxyder des HAP à 4 et 5 cycles, (chrysène et benzo[a]pyrène [4, 5]) (Figure 1).
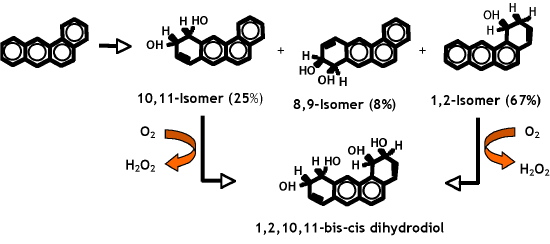
Figure 1 : Réactions d’hydroxylation du benz[a]anthracène catalysées par la dioxygénase de Sphingomonas CHY-1
En collaboration avec des collègues du synchrotron de Brookhaven (USA), la composante catalytique de la dioxygénase de Sphingomonas CHY-1 a été cristallisée et sa structure 3D déterminée à 1,8 Å de résolution [2, 3].
L’enzyme de la souche CHY-1 se distingue d’autres dioxygénases précédemment décrites par sa poche catalytique, beaucoup plus volumineuse et seule capable d’accueillir des substrats à 4 et 5 cycles. En se basant sur la topologie de cette poche, ces chercheurs ont pu prédire la position de substrats comme le benzo[a]pyrène au site actif (Figure 2) et ainsi donner une interprétation structurale de la régiosélectivité * de l’enzyme.
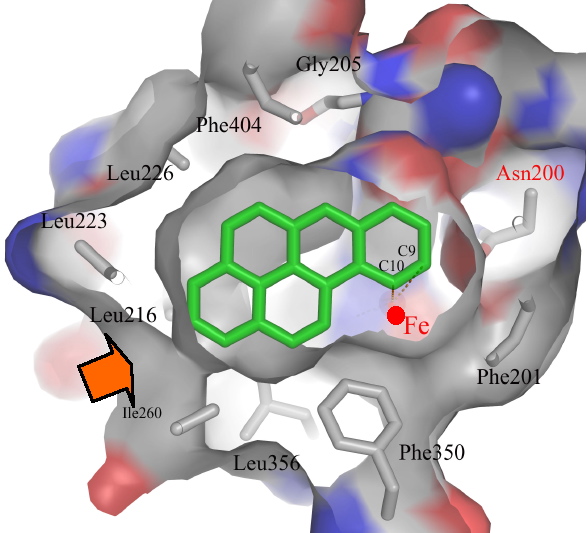
Figure 2 : Image de la poche catalytique de la dioxygénase de la souche CHY-1. Le substrat est représenté en vert. La flèche indique l’entrée de la poche, le point rouge l’ion ferreux situé au site actif de l’enzyme.
À terme, les deux principaux objectifs des chercheurs sont les suivants : le premier est de mieux comprendre le mode de fonctionnement de ce type d’enzyme, notamment ce qui détermine la sélectivité catalytique, par l’analyse structurale d’autres dioxygénases et celle de complexes enzyme-substrat. Le second vise à améliorer les performances catalytiques des dioxygénases vis-à-vis des HAP récalcitrants par une approche d’ingénierie moléculaire.
Ces recherches ont pour perspective le développement de procédés biotechnologiques innovants destinés à éliminer les polluants organiques des sites contaminés tout en préservant la richesse des écosystèmes.
* Une réaction chimique est dite régiosélective si l'un des réactifs réagit préférentiellement avec certains sites d'un autre réactif parmi plusieurs possibles, conduisant préférentiellement à certains produits parmi plusieurs possibles.