L’assemblage des bio-polymères peut être contrôlé en modulant les paramètres physico-chimiques pour obtenir des objets de morphologies variées et présentant des propriétés fonctionnelles intéressantes. Ces objets ont un large potentiel d’applications convoité par les industries agro-alimentaires, pharmaceutiques et biotechnologiques. Les polymères naturels tels que les protéines, les lipides et les polysaccharides sont d’autant plus intéressants qu’ils sont bio-compatibles et biodégradables. Cependant un pré-requis à l’utilisation de ces objets est la compréhension des forces gouvernant leur formation et leur stabilité, afin de les fabriquer d’une manière contrôlée et de maîtriser leur fonctionnalité.
Dans le cas d’assemblages de protéines, des règles empiriques entre la morphologie des objets formés et les conditions physico-chimiques commencent à émerger. Dans la majorité des cas d’auto-assemblage d’une protéine, par exemple, des objets linéaires sont formés lorsque le pH est éloigné du point isoélectrique (pI) de la protéine, alors que des objets sphériques sont observés lorsque le pH est proche du pI. Étudier les mécanismes d’assemblages des protéines à l’échelle moléculaire est nécessaire à la compréhension de ces phénomènes.
Un travail de thèse réalisé dans notre laboratoire, en collaboration avec celui des Sciences et Technologies du Lait et de l’Œuf de l’Inra (Agrocampus de Rennes), a porté sur l’assemblage de l’α-lactalbumine, une protéine acide du lait et le lysozyme, une protéine basique du blanc d’œuf. Lorsqu’elles sont placées ensemble à pH neutre, ces protéines interagissent et forment des objets supramoléculaires. À basse température (< 25 °C), des agrégats amorphes sont obtenus, alors que des microsphères (objets sphériques ordonnés) sont obtenues à une température supérieure à 45 °C. Pour comprendre comment l'information contenue à l'échelle moléculaire se propage à l'échelle microscopique, ces chercheurs caractérisent les interactions impliquées à l'échelle moléculaire pour en définir le mécanisme d'assemblage.
Le processus d’assemblage qu'ils proposent sur la base de leurs récents résultats
[1, 2], est synthétisé dans la
figure.
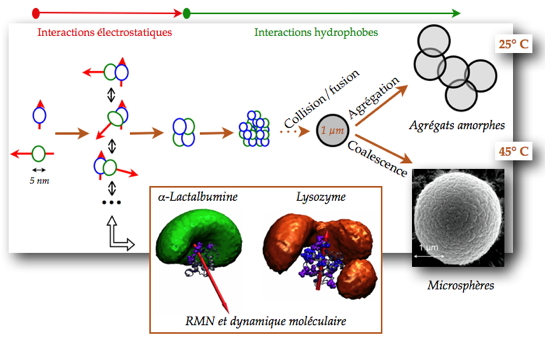
La reconnaissance moléculaire et la formation d’hétérodimères sont gouvernées par des attractions électrostatiques. À ce stade, les interactions entre les deux protéines sont de faible affinité et peu spécifiques
[1]. Cet hétérodimère correspond en fait à un ensemble de conformations principalement définies par les orientations respectives des deux protéines en interaction. l’α-lactalbumine possède un fort moment dipolaire, dû à une distribution de charges non homogène à sa surface ; cela restreint fortement le nombre d’orientations adoptées par le lysozyme. Ce dernier, au contraire, possède un moment dipolaire faible et le nombre d’orientations explorées par l’α-lactalbumine est beaucoup plus important. L’association des hétérodimères en tétramères se fait avec une meilleure affinité que la première étape et mène à une restriction du nombre de conformations accessibles aux protéines. Les étapes ultérieures sont principalement gouvernées par des interactions hydrophobes entre tétramères. Les particules croissent par collision et fusion de petites particules jusqu’à former des particules sub-micrométriques de taille critique
[2]. Enfin, lorsque les protéines sont incubées à 25 °C, les particules sub-micrométriques s’agrègent pour former des amas non ordonnés. À 45 °C les particules sub-micrométriques coalescent et forment des microsphères. L'effet de la température n’est pas encore compris. Néanmoins, la formation des microsphères semble corrélée à une dénaturation partielle de l'α-lactalbumine , ce qui suggère qu’une augmentation de la flexibilité d’une des deux protéines est nécessaire à la formation des microsphères. Cependant, aucun changement significatif de structure n’est observé pour les deux protéines.
Cette approche a permis de suivre avec une résolution inégalée l’assemblage de protéines dans des objets supramoléculaires, avec des informations allant jusqu’à l’échelle moléculaire. Sa généralisation à d’autres systèmes devrait mener à une meilleure compréhension de ces assemblages et permettre ainsi la conception rationnelle de nouveaux biomatériaux.