Les protéines à centre fer-soufre (FeS) sont impliquées dans de nombreux processus cellulaires tels que la respiration, la réparation de l’ADN ou encore la régulation de gènes. La synthèse des FeS est assurée par un complexe multi-protéique (ISC ou SUF), une des machineries cellulaires les plus conservées au cours de l’évolution qui, lorsque défaillante chez l’homme, entraîne de nombreuses maladies telles que des ataxies, anémies, ou myopathies.
La frataxine (FXN) est l’une des quatre protéines composant le complexe ISC dont l’absence chez les eucaryotes conduit à des phénotypes drastiques : accumulation de fer dans la mitochondrie, diminution importante de l’activité d’enzymes à centre FeS ou encore dommages oxydatifs. Un déficit chez l’homme est responsable de l’ataxie de Friedreich, une maladie neurodégénérative. La fonction de la frataxine restée longtemps inconnue a récemment été dévoilée par les travaux menés dans dans notre laboratoire. Les chercheurs ont démontré que FXN contrôle l’arrivée du fer dans le complexe via la production de soufre. À la différence des eucaryotes, l’absence de l’homologue bactérien de la frataxine chez les procaryotes, CyaY, ne conduit pas aux phénotypes évoqués, questionnant sur sa fonction biologique.
Une étroite collaboration avec le groupe de F. Barras (CNRS Marseille) nous a permis de déterminer
in vivo que CyaY favorise la formation des centres FeS
via la machinerie ISC. De plus, ces travaux ont permis de déterminer les bases moléculaires pouvant expliquer les différences de phénotypes observées entre les eucaryotes et les procaryotes liées à l’absence de FXN. En effet, nous avons montré que Isu, un autre partenaire du complexe ISC, jouait un rôle clé pour la dépendance de CyaY. Nous nous sommes ainsi inspirés des travaux de Yoon
et al. montrant en
2012 qu’une mutation en position 141 de Isu1 chez la Levure (équivalente à la position 108 de l’IscU des procaryotes) était capable de supprimer les phénotypes liés à un défaut en FXN. Cette mutation située à une position très conservée chez les Isu eucaryotes, remplace une méthionine en isoleucine. Etonnamment, la position correspondante chez les procaryotes est une isoleucine! De façon incroyable, lorsqu’on « eucaryotise »
E. coli en remplaçant dans CyaY l’isoleucine 108 par une méthionine, CyaY devient alors essentielle pour la synthèse des FeS, « mimant » ainsi l’importance de la FXN chez les eucaryotes. Les études biochimiques réalisées
in vitro ont montré que ce mutant d’IscU présente une capacité réduite pour assembler un cluster FeS et permet donc de confirmer l’importance de CyaY
in vivo pour la formation des centres FeS
via ISC.
Autant d’informations qui permettront à l’équipe Biocatalyse de comprendre au niveau moléculaire le processus d’assemblage fin des FeS.
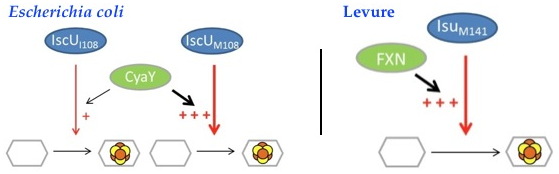
Chez E. coli dans un contexte wt (IscUI108) l’effet de CyaY sur la formation des FeS est mineur. Une souche d’E. coli dans laquelle le résidu Isoleucine 108 de IscU est substitué en méthionine devient complètement dépendante de CyaY pour la synthèse des FeS, mimant les phénotypes associés à l’absence de FXN chez la Levure.