L’oxyde nitreux (N2O) est une molécule très agressive vis-à-vis de la couche d’ozone, mais aussi un gaz à effet de serre redoutable puisqu’il possède une capacité de réchauffement 300 fois supérieure à celle de CO
2[1]. Ses sources de production principales sont les industries de production des acides nitriques et adipiques, l’agriculture intensive et le trafic routier. N
2O a également des effets néfastes directs sur la Santé puisqu’il peut provoquer, dans des conditions d’expositions prolongées, jusqu’à des troubles cérébraux sévères et voire des dommages irréversibles de l’ADN. Sa capacité d’inhibition de la méthionine synthase a pu être mise en relation avec ces pathologies
[2, 3]. Dans ce dernier cas, la mise au point de systèmes de détection rapides et fiables revêt donc d’un intérêt évident. Les méthodologies actuelles, basées sur l’infrarouge à transformée de Fourier ou de la chromatographie en phase gaz sont très couteuses à mettre en place et finalement peu précises.
Pour ce faire, notre approche est de nous inspirer de la Nature puisque N
2O est aussi une molécule utilisée et produite par le Vivant. La réductase de N
2O (N
2Or) est en effet capable, lors du processus de nitrification/dénitrification bactérien, de réduire N
2O en N
2. Sa structure cristallographique a été résolue et indique la présence d’un site tétranucléaire de cuivre à environnement S/N unique en son genre
[4-6]. De nombreuses études mécanistiques (combinant expériences et théorie) ont été menées depuis des années et convergent maintenant vers un adduit N
2Or/N
2O tel que représenté Figure 1 pour lequel le substrat serait coordiné par deux des quatre ions cuivre avec une stabilisation
via liaison hydrogène
[7]. L’idée a été de structuralement contraindre le site actif à son unité fonctionnelle minimale. La réduction de N
2O étant un processus biélectronique, l’utilisation de complexes dinucléaires de cuivre parait opportune. A partir de la structure générale présentée Figure 1, une série de complexes a été préparée puis caractérisée avant d’en étudier la réactivité. L’objectif sous-jacent, en cas de succès, sera d’établir des corrélations structure/activité pour pouvoir, à terme, proposer des composés de plus en plus efficaces.
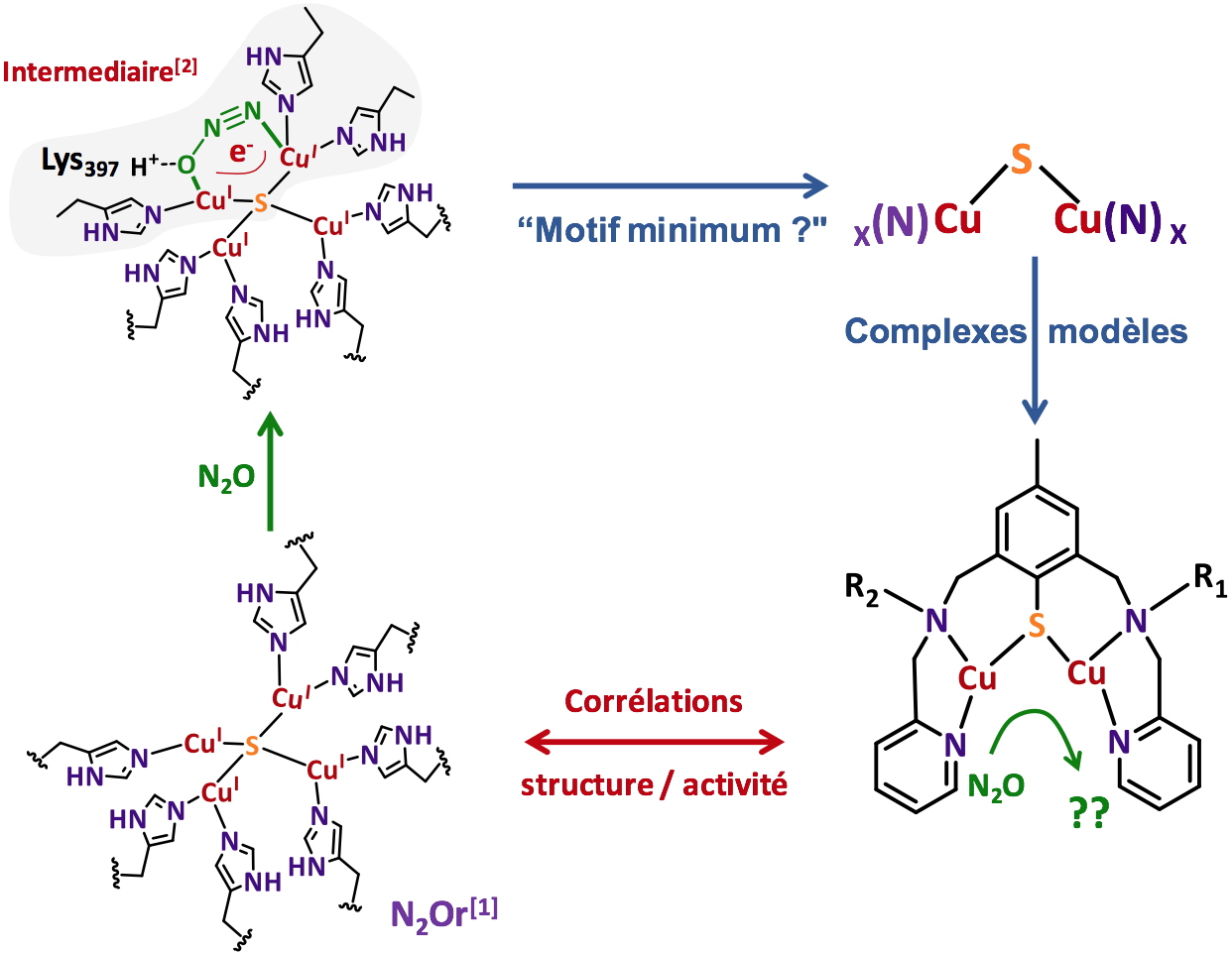 Figure 1
Figure 1. Site actif de la N
2Or, intermédiaire postulée et principe de l’approche bio-inspirée pour la conception des complexes dinucléaires du cuivre à environnement N/S.
Coord. Chem. Rev.2019, 387, 436-449
Chem. Rev.2014, 114, 3689-3853
J. Am. Chem. Soc.2017, 139(12), 4462-4476
Les motifs synthétisés, à partir des ligands précurseurs disulfures correspondants, sont représentés sur la Figure 2. Chaque sphère de coordination du cuivre est unique et correspond à la diversité structurale recherchée.
Tous sont isolés à l’état valence mixte (VM), CuIICuI. Leurs propriétés électroniques ont été établies en combinant une approche expérimentale de Résonance Paramagnétique Electronique (RPE), spectrophotométrie UV-vis/NIR, Résonance Magnétique Nucléaire (RMN), cristallographie (RX) et électrochimie avec des calculs théoriques de types DFT ou TDDFT (collaboration Dr M. Orio – iSm
2 Marseille). Les caractères VM délocalisés se traduisent par des spectres RPE complexes dont les paramètres ne peuvent être obtenus que par des simulations. Ils sont plus simples et s’apparentent à des espèces mononucléaires lorsque la valence est localisée.
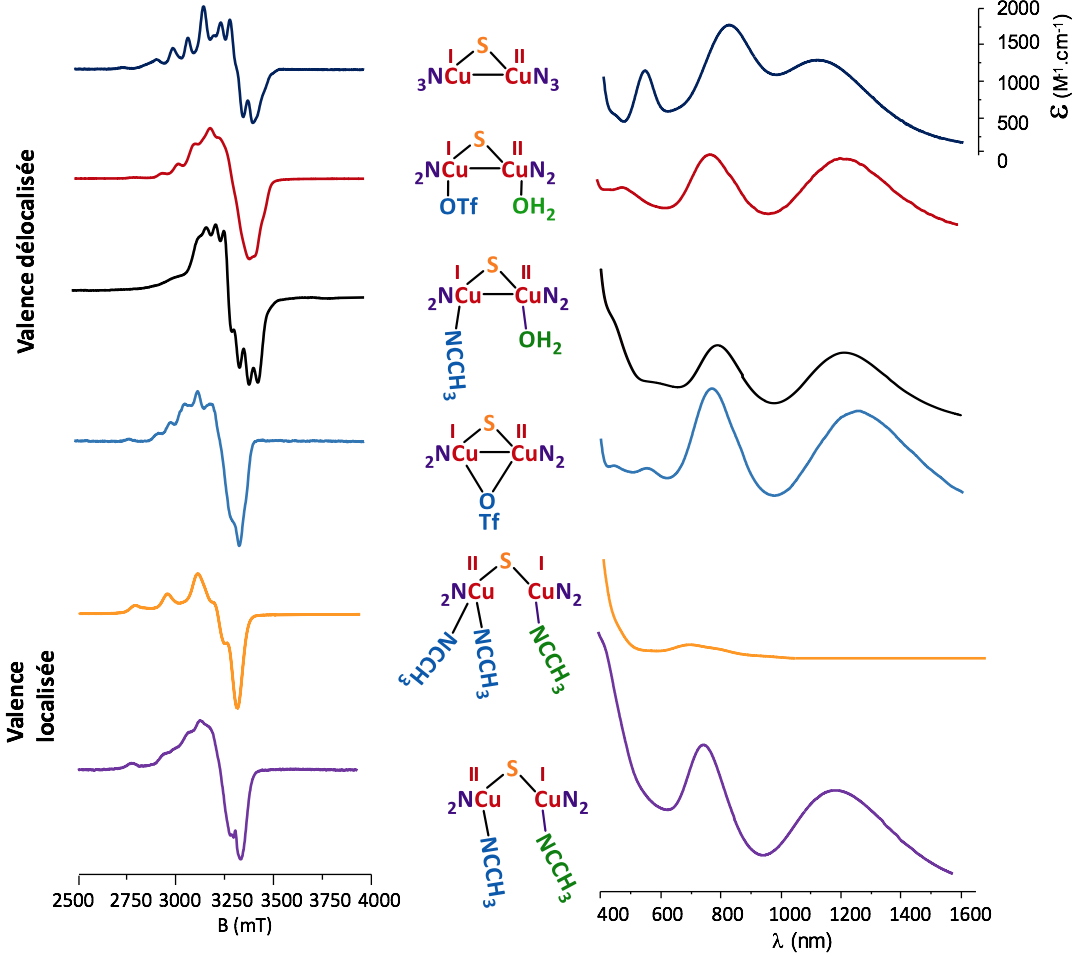
Figure 2. Caractéristiques RPE et UV-vis/NIR des complexes isolés.
Les signatures en UV-vis/NIR sont aussi révélatrices de cet état VM, lorsqu’il est délocalisé, avec des bandes aux environs de 1200-1400 nm. Les propriétés électrochimiques sont aussi assez différentes en fonction des espèces et très sensibles comme pour les autres techniques, aux solvants utilisés. Enfin, l’obtention de structures cristallographiques permet de mieux apprécier les environnements des cations métalliques ainsi que de mener des études théoriques pour déterminer les propriétés à l’état solide (Figure 3). En combinant études en solution et en solide, les structures "réelles" de ces complexes dans les deux solvants d’étude que sont l’acétonitrile (MeCN) et l’acétone (Me
2CO) ont été déterminées. Elles sont de première importance pour les tests de réactivité, car elles permettent de rendre compte de l’état initial d’un complexe donné avant réaction avec N
2O.
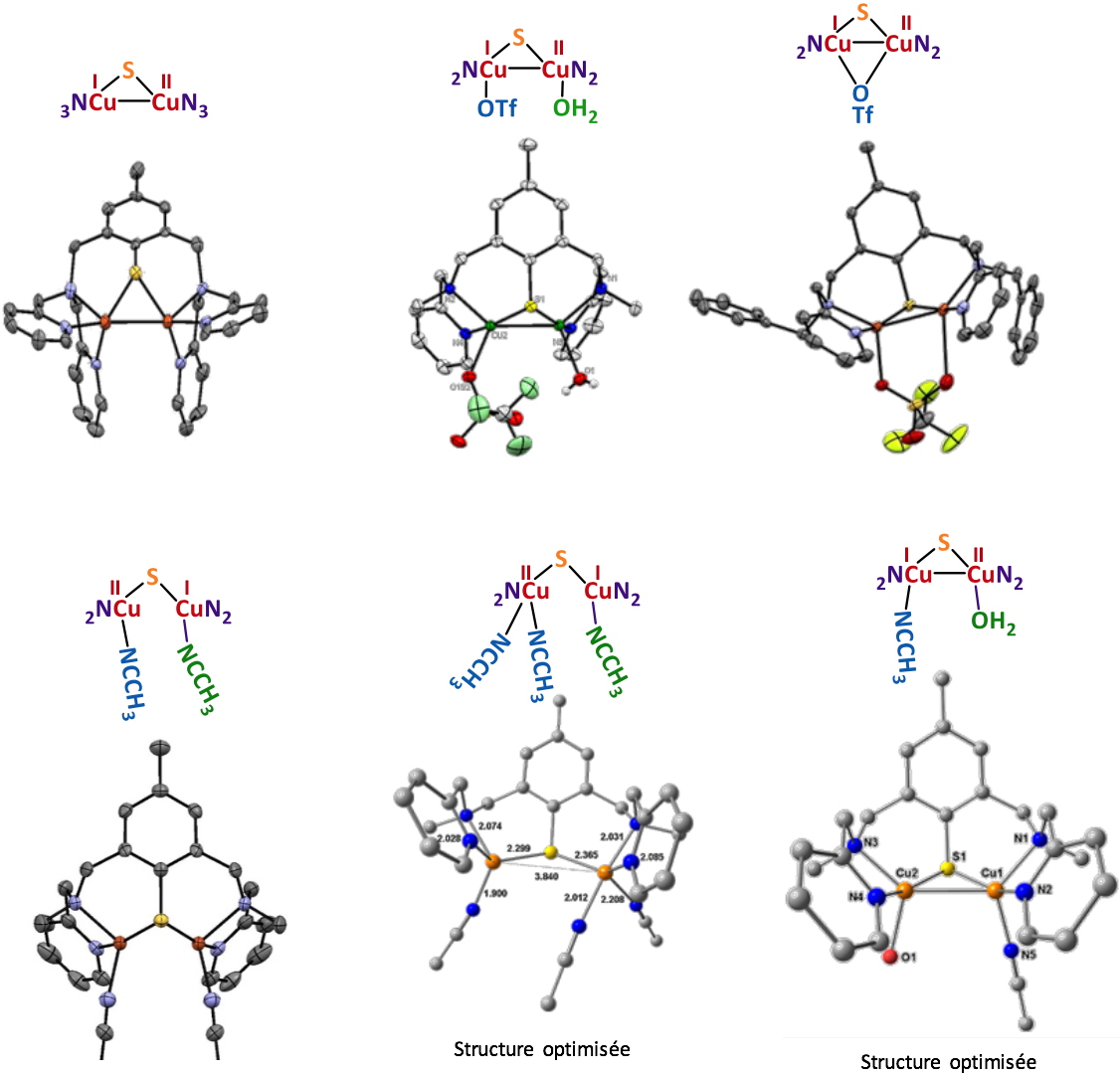
Figure 3. Structures cristallographiques ou optimisées des complexes isolés.
La connaissance de ces structures a ensuite permis de procéder à des tests de réduction de N2O en conditions stœchiométriques.
Il s’avère que seuls les complexes qui possèdent, en première sphère de coordination, une molécule d’eau liée sont actifs (Figure 4).
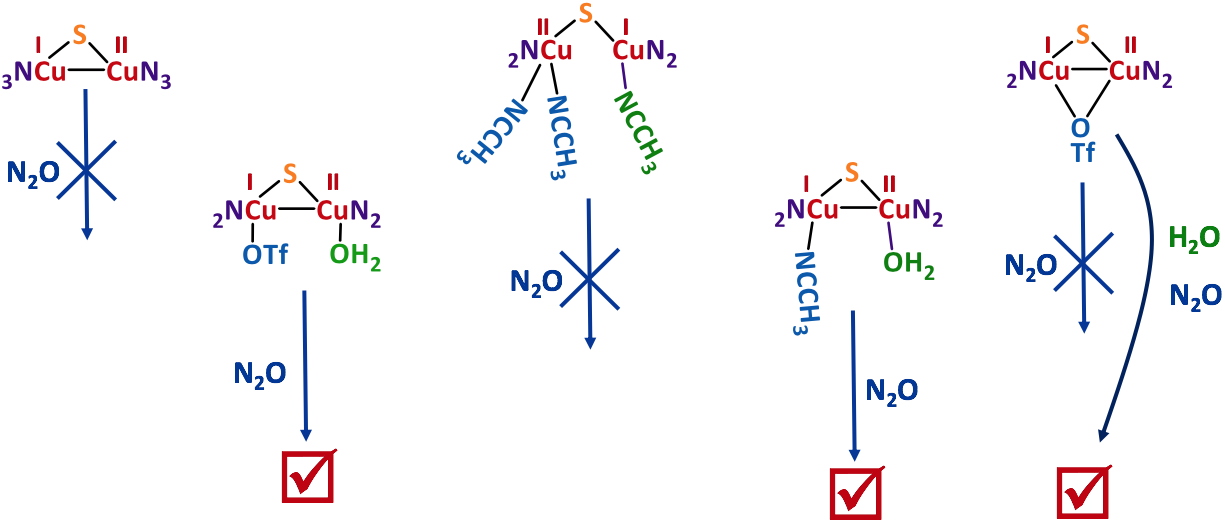
Figure 4. Environnements actifs pour la réduction stœchiométrique de N2O à température ambiante.
Un exemple d’étude mécanistique pour expliquer ce résultat est présenté Figure 5. Le caractère "labile" de la molécule d’eau permettrait la coordination du substrat et la formation d’un adduit actif.
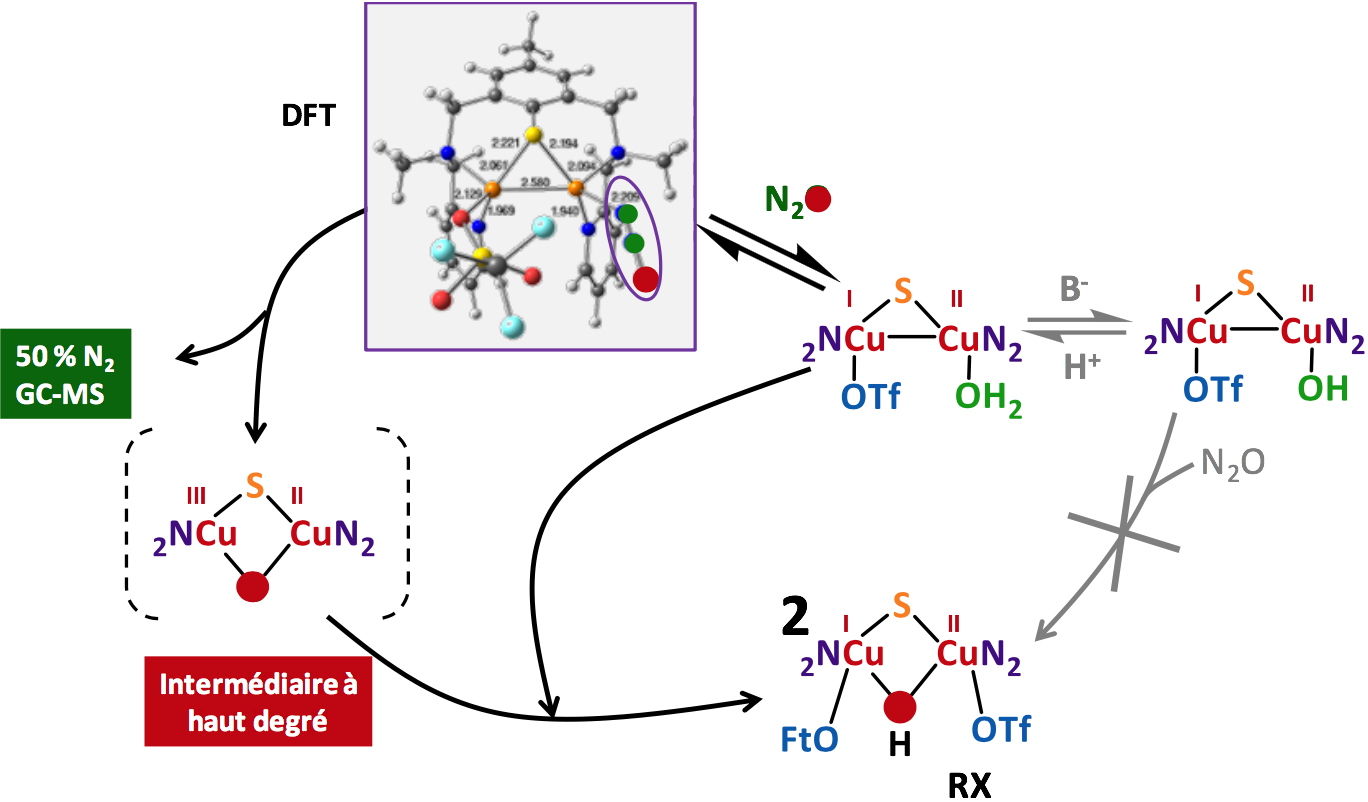 Figure 5
Figure 5. Mécanisme proposé pour rendre compte de l’activité N
2Or d’un complexe présentant une molécule d’eau en première sphère de coordination.
Les complexes actifs présentés plus haut restent à ce jour les seuls exemples d’entités dinucléaires du cuivre VM et à environnement N/S capables de réduire N2O en conditions stœchiométriques et à température ambiante.Les résultats présentés ont fait l’objet des publications suivantes :
• Esmieu C, Orio M, Ménage S, Torelli S.
Inorg. Chem.
2019, 58 (17), 11649-11655
• Esmieu C, Orio M, Mangue J, Pécaut J, Ménage S, Torelli S.
Chem. Eur. J.2018, 24 (20), 5060-5063
• Mangue J, Dubreucq Q, Pécaut J, Ménage S, Torelli S.
ChemistrySelect
2016, 1 (20), 6345-6348
• Esmieu C, Orio M, Le Pape L, Lebrun C, Pécaut, J, Ménage S, Torelli S.
Inorg. Chem.
2016, 55 (12), 6208-6217
• Esmieu C, Orio M, Torelli S, Le Pape L, Pecaut J, Lebrun C, Ménage S.
Chem. Sci.
2014, 5 (12), 4774-4784
• Torelli S, Orio M, Pécaut J, Jamet H, Le Pape L, Ménage S.
Angew. Chem. Int. Ed.
2010, 49 (44), 8249-8252
Références bibliographiques[1] Ravishankara, A. R, Daniel, J. S, Portmann, R. W., Science
2009, 326 (5949), 123-125
[2] Weimann, J., Best Practice & Research Clinical Anaesthesiology
2003, 17 (1), 47-61
[3] Deacon, R, Lumb, M, Perry, J, Chanarin, I, Minty, B, Halsey, M, Nunn, J., Eur. J. Biochem.
1980, 104 (2), 419-422
[4] Pauleta, S. R, Dell'Acqua, S, Moura, I., Coord. Chem. Rev.
2013, 257 (2), 332-349
[5] Dell’Acqua, S, Pauleta, S, Paes de Sousa, P, Monzani, E, Casella, L, Moura, J, Moura, I., J. Biol. Inorg. Chem.
2010, 15 (6), 967-976
[6] Pomowski, A, Zumft, W. G, Kroneck, P. M. H, Einsle, O., Nature
2011, 477 (7363), 234-237
[7] Pauleta, S. R, Carepo, M. S. P, Moura, I., Coord. Chem. Rev.
2019, 387, 436-449