Le 2-éthylhexyl nitrate (2-EHN) est un composé de synthèse utilisé comme additif dans les carburants diesels pour en améliorer la combustion. Le 2-EHN est fabriqué par estérification du 2-éthylhexanol par l’acide nitrique, et produit à raison de 100 000 t/an dans le monde, essentiellement en France. À terme, son usage sera réglementé par la directive européenne REACH, c’est-à-dire que les effets du 2-EHN sur l’environnement et la santé humaine devront être connus. Ce n’est pas le cas actuellement, justifiant ainsi l’étude de biodégradabilité du 2-EHN que l’équipe dirigée par Yves Jouanneau du laboratoire de Chimie et de Biologie des Métaux a entreprise en collaboration avec le Département de Biotechnologie de l’Institut Français du Pétrole. L’étude menée par Élodie Nicolau dans le cadre de sa thèse soutenue fin 2008, avait pour objectifs d’isoler des bactéries capables de dégrader le 2-EHN, d’élucider les étapes de la dégradation et d’identifier les enzymes impliquées.
Le 2-EHN a une structure d’alcane en C8 et représente de ce point de vue une source de carbone potentielle pour certains micro-organismes. Cependant, son caractère hydrophobe, sa structure branchée et sa toxicité le rendent très récalcitrant à la biodégradation. En utilisant des conditions de culture particulières, plusieurs souches bactériennes capables de dégrader le 2-EHN ont été mises en évidence : ces souches sont exclusivement apparentées à l’espèce Mycobacterium austroafricanum. Le suivi cinétique et le bilan carboné de dégradation du 2-EHN ont montré que sa dégradation était incomplète [1, 2], conduisant à l’accumulation d’un métabolite en C6, la ß-méthyl-γ-butyrolactone. Une voie de dégradation a été proposée, impliquant notamment une alcane hydroxylase et les enzymes de la ß oxydation des acides gras [3] (Figure).
Les protéines participant à la dégradation du 2-EHN ont été recherchées par l’approche protéomique dans une souche de Mycobacterium se montrant la plus efficace. La comparaison de profils des protéines cytoplasmiques séparées par électrophorèse bidimensionnelle a conduit à la mise en évidence de 35 protéines induites par le 2-EHN. En outre, une analyse plus exhaustive du protéome de cette souche a permis d’identifier plus de 1 300 protéines par comparaison de leur séquence peptidique avec celle de protéines déduites du séquençage du génome d’une mycobactérie voisine (collaboration avec l'équipe EDyP du laboratoire Biologie à Grande Échelle de notre institut). Au total, 365 protéines se sont avérées plus abondantes quand cette souche était exposée au 2-EHN. L’ensemble des enzymes requises pour la biodégradation du 2-EHN a été découvert (Figure). La première étape est probablement catalysée par une forme rare de cytochrome P450 (type CYP153), capable d’hydrolyser les alcanes à chaîne moyenne (C6 à C10).
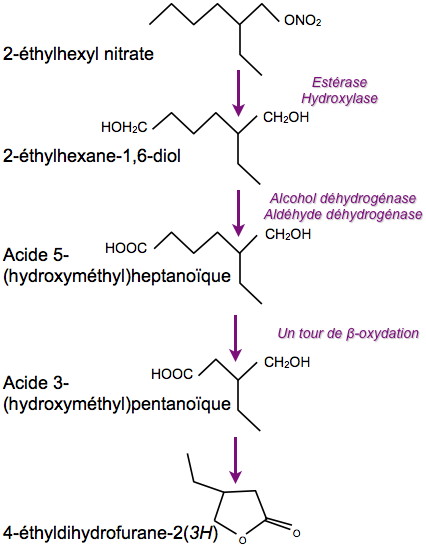
Voie de dégradation du 2-éthylhexyl nitrate par Micobacterium.
Ces recherches ont pour perspective le développement de procédés biotechnologiques innovants destinés à éliminer les polluants organiques des sites contaminés. Les protéines et les gènes spécifiques de la dégradation du 2-EHN constituent des biomarqueurs utiles pour détecter la présence de systèmes de biodégradation adaptés.