Les protéines fer-soufre sont des protéines essentielles qui contiennent dans leur site actif des assemblages d'atomes de fer et de soufre (centres fer-soufre). Les deux premiers systèmes découverts comme étant impliqués dans la biosynthèse des centres (FeS) chez Escherichia coli, les systèmes ISC (Iron Sulfur Cluster) et SUF (SUlFur), constituent de véritables machineries multiprotéiques. Elles assurent, tout à la fois, l'apport et le transport de fer, de soufre, la formation d'unités (FeS) au sein de protéines clé (les protéines « scaffold ») et le transfert de ces unités à des protéines cibles.
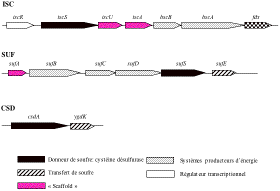
Machineries impliquées dans l'assemblage des (FeS)
Le système récemment découvert, baptisé CSD (Cysteine Sulfinate Desulfinase), est par comparaison d'une extrême simplicité. Il n'est composé que de 2 protéines, CsdA et CsdE dont la fonction est de fournir du soufre à partir d'un acide-aminé, la L-cystéine. CsdA possède une activité dite cystéine désulfurase : le soufre est mobilisé à partir de la cystéine et stocké dans CsdA sous forme d'un intermédiaire persulfure stable. Par une réaction de transpersulfuration, CsdE récupère le soufre porté par CsdA (également sous forme de persulfure). Ce dernier est transféré aux protéines cibles pour la construction du (FeS). Le système ne comporte ni protéines scaffold, ni chaperones.
Ce nouveau système jouerait un rôle spécifique dans la maturation d'une protéine particulière, la protéine NadA, impliquée dans la biosynthèse du Nicotinamide Adénine Dinucléotide et identifiée par le laboratoire comme étant une protéine fer-soufre.
La découverte de ce système remet en cause l'hypothèse d'un rôle central des protéines « scaffold » clés dans la biosynthèse des protéines FeS et par cela les mécanismes moléculaires associés.