L'oxygène est à la fois indispensable et dangereux pour les êtres vivants qui l'utilisent, qu'ils soient d'origine eucaryote ou procaryote. La réduction incomplète d'O2 en H2O par les organismes qui respirent génère des espèces réactives de l'oxygène (ROS), telles que l'anion superoxyde, le radical hydroxyle et le peroxyde d'hydrogène. Ces espèces très nocives pour les cellules peuvent attaquer les membranes cellulaires, les protéines et les acides nucléiques. En conditions de stress oxydant (concentration anormalement élevée en ROS), les cellules mettent en place des systèmes de détoxication qui reposent essentiellement sur l'expression d'enzymes capables de dégrader les ROS.
De façon générale, l'expression de ces enzymes est sous contrôle d'un régulateur. Chez Bacillus subtilis la protéine PerR, activée spécifiquement par H2O2, est le régulateur transcriptionnel des gènes impliqués dans la résistance au stress peroxydique. La littérature indique que la détection d'H2O2 se fait au niveau d'un site métallique de régulation ayant une forte affinité pour le Fe2+. L'oxydation de deux ligands histidine conduit alors à l'inactivation de la protéine et à la levée de répression.
Des chercheurs de notre laboratoire, en collaboration avec le Groupe Synchrotron du laboratoire de Cristallographie et Cristallogenèse des Protéines de l'Institut de Biologie Structurale, ont résolu la structure cristallographique de la protéine PerR (apo-PerR-Zn) à 1,7 Å de résolution. Cette structure montre que les 4 cystéines de la protéine sont impliquées dans la coordination d'un atome de zinc. Ce site à zinc, peu sensible à H2O2, joue un rôle essentiellement structural dans la stabilisation du dimère. Des essais de modélisation moléculaire basés sur la structure de la protéine apo-PerR-Zn ont également permis d'identifier un deuxième site métallique.
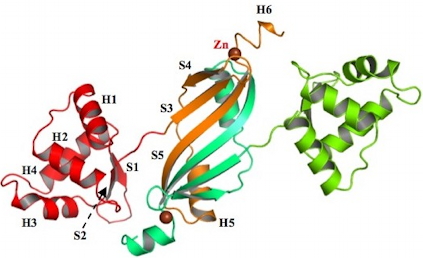
Ce site potentiel de régulation qui fait intervenir 5 ligands (3 His et 2 Asp) est en parfait accord avec la littérature qui démontre par des données biochimiques l'importance de ces ligands dans l'activation de PerR.