Helicobacter pylori est une bactérie pathogène qui colonise l’estomac humain de la moitié de la population mondiale. Cette infection peut évoluer vers des ulcères ou des cancers. H. pylori est la seule bactérie considérée comme
cancérigène de classe 1.
Le fer et le nickel sont des ions essentiels à la survie de
H. pylori dans sa niche acide. Par exemple, de fortes quantités de nickel sont nécessaires au fonctionnement de l’uréase, une enzyme essentielle à la résistance à l’acidité et donc à la virulence de
H. pylori. Afin d’acquérir des quantités suffisantes de nickel tout en se protégeant des effets nocifs de l’excès de métal, ce micro-organisme a développé des mécanismes de contrôle qui impliquent les protéines NikR et Fur. Ces protéines, appelées métallorégulateurs, sont des
régulateurs transcriptionnels de l’expression des gènes répondant l’un au nickel, l’autre au fer. La liaison d’ions divalents au métallorégulateur modifie sa conformation, ce qui permet sa fixation à des séquences spécifiques de la région promotrice des gènes régulés. Un réseau complexe de régulations par l’acidité, le fer et le nickel a été mis en évidence avec en particulier des régulations croisées : NikR et Fur s’auto-régulent, se régulent l’un l’autre et régulent tous deux l’expression de certains gènes comme
exbB exbD tonB codant pour la machinerie énergétique nécessaire à l’importation de métaux (Figure).
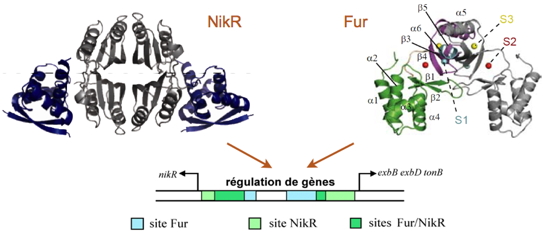
Régulations croisées par les deux métallorégulateurs NikR et Fur avec recouvrement des sites de fixation à l’ADN.
Les propriétés structurales et les mécanismes d’action des NikR et Fur ont été étudiés avec la mise en évidence de sites secondaires pour la liaison des métaux (un site structural à zinc S1, un site de régulation essentiel à la liaison à l’ADN S2 et un site secondaire S3.
Comprendre les mécanismes moléculaires permettant ces régulations de l’homéostasie des métaux chez
H. pylori est particulièrement intéressant.
• Du cellulaire à l’échelle atomique : une approche pluridisciplinaire pour disséquer les mécanismes de détection des métaux chez
H. pylori
Le projet interdisciplinaire, financé par l’ANR a impliqué trois équipes utilisant des approches différentes pour répondre à une même question biologique : (i) une équipe de microbiologistes de l’Institut Pasteur experte de
H. pylori (ii) une équipe de structuralistes de l’ESRF qui avait résolu les premières structures de NikR d’H. pylori et (iii) des chercheurs de notre laboratoire qui étudient au niveau moléculaire, les propriétés de liaison à l’ADN des métallorégulateurs Fur et NikR de
E. coli.
Pour ce faire, des approches complémentaires ont été utilisées combinant des études
in vivo (microbiologie/biologie moléculaire) à des études
in vitro (biochimie des interactions protéine-protéine, protéine-métal et protéine-ADN, spectroscopie) et des analyses à l’échelle atomique (cristallographie des rayons X et diffusion aux petits angles (SAXS)).
Dans un premier temps, ces chercheurs ont mis en évidence
[1] un nouveau mécanisme d’activation de NikR qui démontre l’existence d’un site métallique secondaire capable de modifier l’affinité de de cette métalloprotéine à certaines séquences d’ADN par la rupture d’un pont salin. Dans ce mécanisme, ces chercheurs proposent que NikR adopte une conformation quasi active avant l’activation par le nickel [1]. Ils ont également mis en évidence de nouveaux gènes cibles et montré qu’il y avait une hiérarchie des réponses suite à l’augmentation de la concentration en nickel
in vivo. Enfin, dans cette dernière étude
[2], ils déterminent la première structure cristallographique de Fur chez
H. pylori (Figure), révélant un ensemble unique de trois sites métalliques (un site structural à zinc S1, un site de régulation essentiel à la liaison à l’ADN S2 et un site secondaire S3).
• Des sites secondaires offrent un meilleur contrôle des régulations selon les métaux présents
Des sites secondaires de liaison des métaux ont donc été mis en évidence dans les deux métallorégulateurs. Ces sites permettent de moduler la liaison à l’ADN en fonction des ions métalliques présents dans le milieu. Si l’existence de sites secondaires s’avérait généralisable à d’autres métallorégulateurs, ces chercheurs auraient mis en évidence un nouveau mécanisme de réponse aux variations de l’environnement dont la complexité rend compte de la nécessaire adaptabilité des bactéries telles que
H. pylori.
Un tel mécanisme pourrait ouvrir des perspectives très intéressantes dans une vision fondamentale et intégrative des processus de régulations.
Cancérigène de classe 1 : cette catégorie n’est utilisée que lorsqu’on dispose d’indications suffisantes de cancérogénicité pour l’homme.