La tularémie est une maladie causée par Francisella tularensis, une bactérie Gram-négative hautement pathogène qui peut atteindre l'homme par contact direct avec des animaux infectés (lagomorphes, rongeurs, tiques, moustiques…) [Référence]. F. tularensis est classée agent de bioterrorisme de catégorie A ; en effet, quelques bactéries inhalées par des aérosols suffisent à induire une pneumonie aiguë sévère présentant un taux de mortalité de 30%. Aucun vaccin efficace n'est actuellement homologué et seuls quelques composés antibiotiques à spectres larges sont utilisés comme médicaments.
Nous ét depuis de nombreuses années la protéine FUR*, un métallorégulateur transcriptionnel dont l’activité est dépendante de la concentration en fer et pour lequel l’équipe a développé des inhibiteurs [1]. La multiplication et la virulence de F. tularensis dépendent, entre autre, de l’importance des réserves en fer disponibles chez l’hôte qui, pour se défendre, séquestre le fer libre. La réponse du pathogène à cette privation consiste alors à secréter un sidérophore qui permet de mobiliser le fer mis en réserve par l’hôte. Or, l’expression des gènes impliqués dans la synthèse de ce sidérophore [Référence] est contrôlée par FUR.
Une souche virulente isolée à partir d'un patient souffrant d'une forme typhoïde de tularémie au CHU de Grenoble (centre référence de la tularémie) a été utilisée afin de caractériser in vitro et in vivo la protéine Fur de F. tularensis (FtFur) en collaboration avec le laboratoire TIMC-IMAG et l’IBS. Alors qu’à ce jour la structure de FUR était rapportée sous la forme d’un dimère, les chercheurs présentent la première structure d'une protéine FUR tétramérique constituée de deux dimères entrelacés [2]. De plus, c’est la première fois qu’une structure de FUR est présentée sous une forme pré-activée par le fer, son cofacteur physiologique (Figure).
Une approche couplée a permsi d'utiliser à la fois la modélisation (calculs d'énergie libre) et des études expérimentales pour apporter les preuves d'un mécanisme de dissociation des tétramères induit par des séquences spécifiques d’ADN. Ce phénomène conduit à la formation d’un complexe composé de deux dimères fixés sur l’ADN. Les résidus d'acides aminés de FUR essentiels à cette interaction ont été identifiés.
Le rôle critique de FtFur dans la pathogenèse, démontré dans des macrophages et chez la souris en utilisant un mutant Δfur présentant une virulence atténuée, fait de FtFur une cible anti-virulence prometteuse.
* FUR (Ferric Uptake Regulator) est une protéine bactérienne qui se fixe sur l’ADN pour contrôler l'expression des gènes impliqués dans l'homéostasie du fer, la virulence et le stress oxydatif.
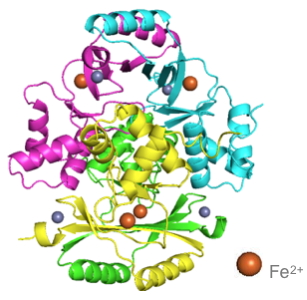
Structure tridimensionnelle de la protéine FUR.
Ce travail a été rendu possible par un financement NRBC CEA, les Labex GRAL et ARCANE ainsi que la région et l’ARC Rhône-Alpes.