Le coenzyme Q (ubiquinone ou Q) est un lipide rédox dont la structure a été établie en 1958. Q est nécessaire au fonctionnement des chaînes respiratoires et donc à la synthèse d’ATP de nombreux organismes. Q a aussi d’autres fonctions cellulaires importantes, notamment comme antioxydant membranaire. La déficience primaire en coenzyme Q est causée par des mutations inactivant des gènes de biosynthèse de Q. Cette déficience entraîne des pathologies sévères [1].
La biosynthèse de Q est conservée dans l’évolution, des bactéries à l’homme, avec quelques différences mineures. Cette biosynthèse ne nécessite pas moins de 9 étapes. Des études conduites chez des organismes modèles, telles la levure Saccharomyces cerevisiae et la bactérie Escherichia coli ont permis d’identifier 9 gènes indispensables à la biosynthèse de Q. La plupart des protéines codées par ces gènes forment un complexe associé à la membrane interne mitochondriale chez les eucaryotes. La fonction de plusieurs protéines de biosynthèse de Q n’est pas connue et des résultats récents suggèrent que d’autres gènes encore non identifiés sont également indispensables.
Des chercheurs de notre laboratoire utilisent la levure S. cerevisiae comme modèle d’étude pour mieux caractériser la voie de biosynthèse de Q. Leurs résultats ont notamment permis d’établir que la protéine Coq6, qui est proposée comme étant une mono-oxygénase à flavine, est impliquée dans une seule des 3 réactions d’hydroxylation que compte la biosynthèse de Q [2]. Les mono-oxygénases à flavine tirent normalement leur pouvoir réducteur du NADH/NADPH. De façon surprenante, la ferrédoxine mitochondriale Yah1 et la ferrédoxine réductase Arh1 ont été décrites comme indispensables à la réaction d’hydroxylation C5 de Q [3]. Ces résultats suggèrent que le système de transport d’électrons ferrédoxine/ferrédoxine réductase pourrait participer à la réduction du cofacteur flavinique de Coq6, une hypothèse actuellement étudiée dans ce laboratoire.
Dans cette même étude, les chercheurs ont mis en évidence que des analogues synthétiques de l’acide 4-hydroxybenzoïque, le précurseur du noyau aromatique de Q (Figure), pouvaient également servir de précurseurs à la biosynthèse de Q. Ajouté au milieu de culture de S. cerevisiae, l’un de ces analogues, l’acide vanillique, VA (Figure), a permis de rétablir la biosynthèse de Q dans une souche mutée pour la protéine Coq6 et donc déficiente pour l’étape d’hydroxylation C5 [2]. L’obtention de ce résultat démontre à quel point une connaissance moléculaire des différentes étapes de la biosynthèse de Q est importante.
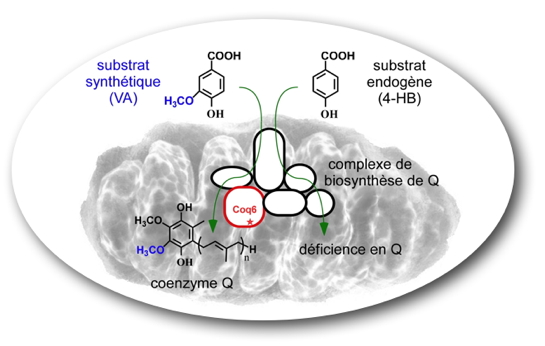
La longueur de la chaîne polyprényle de Q est variable selon les organismes : n= 6 chez la levure Saccharomyces cerevisiae (Q6), 8 chez Escherichia coli (Q8), 10 chez l'Homme (Q10). L’acide 4-hydroxybenzoïque (4-HB) endogène est transformé en coenzyme Q par le complexe regroupant les protéines de biosynthèse dans la matrice mitochondriale des eucaryotes. La mutation d’une des protéines du complexe (Coq6 dans l’exemple) entraîne une déficience en coenzyme Q. En fournissant de façon exogène l’acide vanillique (VA), un analogue synthétique du 4-HB qui contient le groupement chimique normalement ajouté par Coq6, il est possible de rétablir la biosynthèse de Q dans la souche de levure mutée.
En 2011, COQ6 a été le sixième gène de la voie de biosynthèse de Q à être décrit comme porteur de mutations entraînant un déficit primaire en coenzyme Q. À ce jour, les patients sont traités par supplémentation avec le coenzyme Q mais sa nature hydrophobe rend difficile son absorption et son transport jusqu’à la membrane interne mitochondriale.
Les résultats obtenus chez la levure démontrent la possibilité de rétablir la biosynthèse de Q avec des analogues de l’acide 4-hydroxybenzoïque qui présentent l’avantage d’être des molécules hydrophiles. L’utilisation de ces analogues ouvre donc de nouvelles perspectives pour le traitement chez l’homme des déficiences primaires en coenzyme Q.
Lipide rédox. La chaîne polyprényle du coenzyme Q rend cette molécule lipophile. Q est une molécule qui a la capacité de passer d'une forme oxydée à une forme réduite, et donc de transférer des électrons entre les complexes enzymatiques des chaînes respiratoires (de la NADH-déshydrogénase et succinate-déshydrogénase vers la cytochrome c-réductase).