Le cuivre est un métal de transition essentiel au fonctionnement des organismes vivants. Chez la plante Arabidopsis thaliana, la moitié du contenu en cuivre est localisée dans le chloroplaste, majoritairement associée à la superoxide dismutase à cuivre du stroma et à la plasto-cyanine du lumen des thylacoïdes. Chez les plantes, le cuivre joue un rôle clé dans les processus photosynthétiques où il constitue le centre redox de la plastocyanine nécessaire au transfert des électrons photosynthétiques. La plastocyanine étant indispensable à la plante, l’adressage du cuivre aux chloroplastes puis aux thylacoïdes est donc une priorité pour la cellule.
Chez Arabidopsis, l'adressage du cuivre du cytosol au stroma du chloroplaste puis au lumen des thylacoïdes implique deux protéines membranaires appartenant à la famille des ATPases-PIB-1 : HMA6, localisée dans l’enveloppe du chloroplaste et HMA8, localisée dans la membrane des thylacoïdes.
En 2011, la première étude biochimique d’une ATPase-Cu+ de plante a été réalisée par des chercheurs du laboratoire Physiologie Cellulaire & Végétale et de notre laboratoire. Cette étude a permis de déterminer les caractéristiques enzymatiques de HMA6 [1].
Dans la continuité de ce travail, la caractérisation d’HMA8 a révélé des différences significatives entre les propriétés enzymatiques des deux transporteurs [2].
Plus récemment, en collaboration avec l’équipe Membrane Transporters de l’IBS, les structures cristallographiques des domaines de liaison des nucléotides de HMA6 et HMA8 ont été résolues [3].
Dans le dernier volet de leur étude, plusieurs équipes de chercheurs des laboratoire
Physiologie Cellulaire & Végétale et du notre se sont intéressées au cheminement du cuivre à l’intérieur de HMA6 et HMA8, et plus particulièrement à l’étape de libération du métal. Une analyse phylogénétique détaillée sur plus de 100 séquences d’ATPase-Cu
+ a permis d’identifier une séquence conservée Cys-X3-His-X2-His, spécifique de la boucle L1 des ATPases-Cu
+ chloroplastiques (
Figure). La combinaison de tests phénotypiques en levure et de cinétiques enzymatiques sur des mutants d’HMA6 et d’HMA8 produits dans la bactérie
Lactococcus lactis a révélé le rôle essentiel du motif Cys-X3-His dans le fonctionnement des deux transporteurs. À l’aide de modèles 3D, cette étude a permis de proposer un modèle de cheminement du cuivre à l’intérieur des domaines membranaires de HMA6 et HMA8
[4].
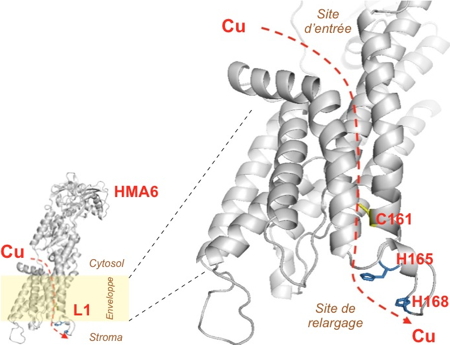
Modèle du transport du cuivre au niveau du domaine membranaire de l'ATPase-Cu+ HMA6.
Les résidus cystéines et histidines de la boucle L1 identifiés et caractérisés biochimiquement dans cette étude sont colorés en rouge. Ils sont nécessaires à la libération du métal.