Chez l’homme, 8% des protéines utilisent un ion zinc pour acquérir la structure tridimensionnelle qui leur permet d’assurer leur fonction
[1]. Les domaines protéiques de liaison du zinc sont appelés « doigts de zinc » et au sein des
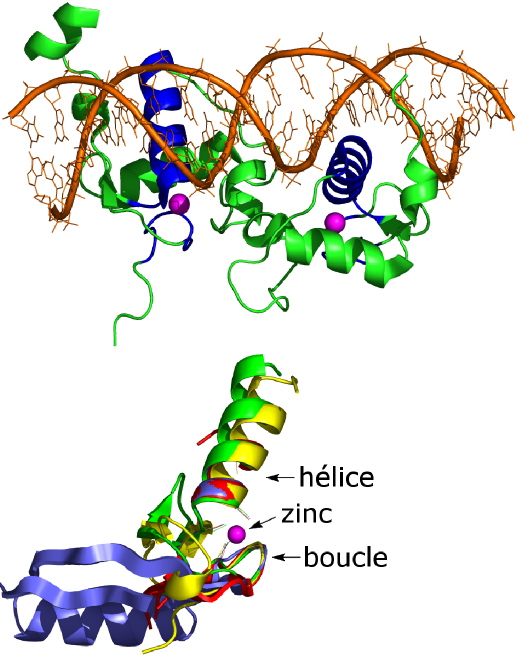
facteurs de transcription, ils sont très souvent situés dans des zones d’interaction protéine/ADN ou protéine/protéine (Figure 1).
Nous développons des modèles de ces sites à zinc afin de mieux les caractériser et comprendre leurs rôles biologiques. Nous avons synthétisé un peptide modèle d’une vingtaine d’acides aminés et montré qu'il pouvait reproduire la structure des doigts de zinc « clé de sol », un des sept grands types de doigts de zinc
[2]. Dans ces sites, le zinc est lié par quatre acides aminés cystéine pour lesquels il a une grande affinité. Deux cystéines sont dans une boucle et deux sont placées au début d’une hélice (Figures 1 et 2) qui constitue souvent l’interface de reconnaissance protéine/ADN.
Ce peptide modèle a été conçu en attachant un peptide linéaire de 14 acides aminés à un peptide cyclique de 8 acides aminés (
Figure 2)
[3].
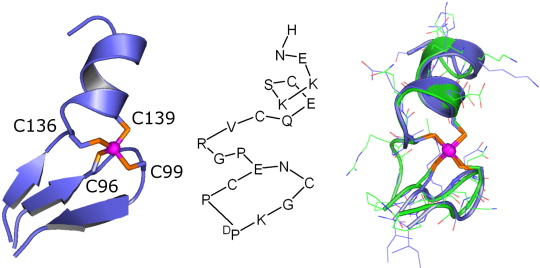
Figure 2 : Zoom sur le site « clé de sol » de la protéine PerR
[5] (à gauche), peptide modèle de ce site (au milieu) et superposition du site à zinc de PerR (en bleu) et du peptide modèle (en vert).
 Sa petite taille a permis de l'étudier beaucoup plus précisément que les protéines à doigt de zinc composées de plusieurs centaines d’acides aminés. Les chercheurs de cette équipe ont mis en évidence plusieurs aspects très intéressants. Premièrement, ce peptide modèle reproduit parfaitement la structure du site « clé de sol » autour du métal. Cette étude a montré que l’affinité d’une protéine pour le zinc peut être bien supérieure à ce qui était généralement admis depuis que ces doigts de zinc sont étudiés et pour lesquels ces constantes d'association étaient largement sous évaluées. Ces chercheurs ont enfin montré que la présence de zinc était indispensable pour que la partie linéaire de ce peptide modèle acquière la structure d'une hélice à deux tours. Le zinc sert ainsi de gabarit pour induire la formation de l’hélice des sites « clé de sols ».
Sa petite taille a permis de l'étudier beaucoup plus précisément que les protéines à doigt de zinc composées de plusieurs centaines d’acides aminés. Les chercheurs de cette équipe ont mis en évidence plusieurs aspects très intéressants. Premièrement, ce peptide modèle reproduit parfaitement la structure du site « clé de sol » autour du métal. Cette étude a montré que l’affinité d’une protéine pour le zinc peut être bien supérieure à ce qui était généralement admis depuis que ces doigts de zinc sont étudiés et pour lesquels ces constantes d'association étaient largement sous évaluées. Ces chercheurs ont enfin montré que la présence de zinc était indispensable pour que la partie linéaire de ce peptide modèle acquière la structure d'une hélice à deux tours. Le zinc sert ainsi de gabarit pour induire la formation de l’hélice des sites « clé de sols ».
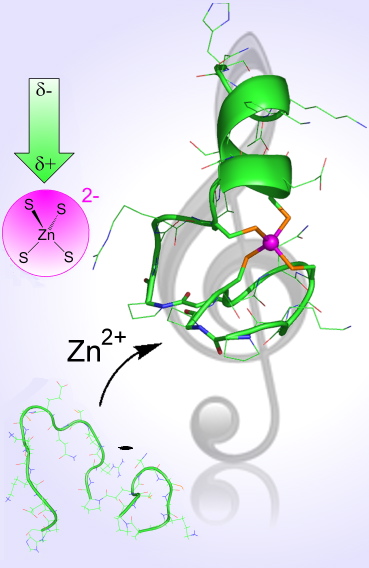
Enfin, la comparaison de ce peptide avec un autre présentant une partie linéaire plus petite, qui ne peut pas former le deuxième tour de l’hélice, a mis en évidence que le zinc se liait plus fortement au peptide le plus long. L’hélice stabilise la liaison du zinc à la protéine par une interaction électrostatique entre le site à zinc chargé négativement et le dipôle constitué par l'hélice (Figure 3 ci-dessus).
Nous proposons donc un mécanisme pour l'interaction entre le zinc et la protéine avec une synergie entre les deux partenaires : le zinc joue un rôle essentiel en repliant correctement la protéine pour former l’hélice nécessaire à la liaison à l’ADN et cette hélice joue le rôle de verrou en permettant à la protéine d’attacher plus fortement le zinc.
* Un facteur de transcription est une protéine nécessaire à l'initiation ou à la régulation du passage de l’ADN à l’ARN messager (transcription).