L’oxygène singulet (1O2) est une forme activée de l’oxygène qui est générée dans tous les organismes mais plus particulièrement dans les organismes photosynthétiques et dans les macrophages et les neutrophiles chez les mammifères. En raison de sa structure électronique, 1O2 est un oxydant fort qui peut endommager les composants de la cellule : ADN, l'ARN, les protéines et les membranes.
Chez certaines bactéries, les défenses contre l’oxygène singulet qui font suite à un stress photo-oxydant sont sous le contrôle de deux facteurs, σE et anti-σ ChrR. Il est proposé que σE est inhibé par son interaction avec ChrR, une protéine à
doigts de zinc, et que cette inhibition est levée par la destruction du site à doigt de zinc par
1O
2. Récemment, il a été proposé que des protéines à doigts de zinc seraient impliquées dans la détection cellulaire de l’oxygène singulet ; mais la base moléculaire de ce processus demeure inconnue.
Devant l’absence de données dans la littérature ds chercheurs de notre laboratoire ont entrepris d’étudier leur réactivité en utilisant des peptides modèles (
Figure). La démarche utilisée a consisté dans un premier temps à déterminer la nature chimique des produits de la réaction entre un modèle de site à doigt de zinc de type Zn(Cys)
4 et
1O
2 et ensuite à mesurer les cinétiques de réaction afin d’évaluer la pertinence biologique de la réaction. L’analyse des produits primaires d’oxydation a révélé que les cystéines sont majoritairement oxydées en sulfinates CysO
2- (
Figure), ce qui provoque une libération du zinc et le dépliement de la protéine. Grâce à des mesures photo-physiques réalisées en collaboration avec une équipe de l’Institut des Sciences Moléculaires de Bordeaux, la constante de vitesse de la réaction a été évaluée : elle est très élevée et supérieure à celles des acides aminés qui constituent le protéines. Elle est aussi du même ordre de grandeur pour des doigts de zinc de structure différente Zn(Cys)
2(His)
2. Ceci montre que
1O
2 est capable d’oxyder les doigts de zinc, quelle que soit leur nature.
Il est donc raisonnable de penser que les protéines à doigt de zinc sont des cibles potentielles de
1O
2 et que leur oxydation provoque la libération du zinc et la perte de la structuration associée. ChrR agirait donc dans les cellules tel un senseur de
1O
2.
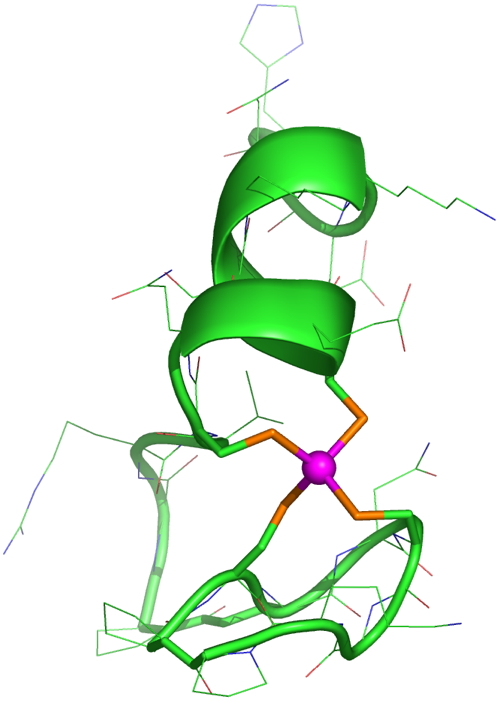 Structure en solution du modèle Zn·LTC utilisé pour cette étude (le zinc est en rose et les soufres des cystéines en orange).
Structure en solution du modèle Zn·LTC utilisé pour cette étude (le zinc est en rose et les soufres des cystéines en orange).
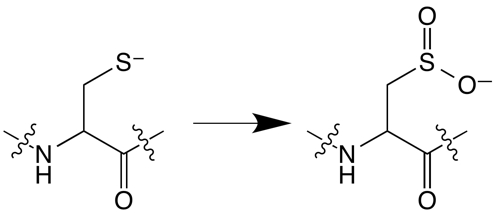
Oxydation d’une cystéine en sulfinate.
Les doigts de zinc sont de petits motifs structuraux trouvés dans les protéines et qui leur permettent d’acquérir leur structure tridimensionnelle. Ils peuvent également servir de domaine d’interaction pour lier de l'ADN, de l'ARN ou d’autres protéines.