Magnétisme et structure électronique de centres biomimétiques à fer et à manganèse
Publié le 25 janvier 2019
Corps de texte 1
 Responsables
Responsables
|
Dr. Geneviève Blondin
Directrice de Recherches CNRS
Mail : Genevieve.Blondin@cea.fr
Tel. : 04 38 78 38 47
Fax : 04 38 78 54 65 |
|
Dr. Ricardo Garcia
Maître de Conférences Université Grenoble Alpes
Mail : Ricardo.Garcia@cea.fr
Tel. : 04 38 78 62 06
Fax : 04 38 78 54 65 |
| Dr. Martin Clémancey
Ingénieur d'études UniversitéGrenoble Alpes
Mail : martin.clemancey@cea.fr
Tel. : 04 38 78 02 06
Fax : 04 38 78 54 65 |
 Adresse
Laboratoire Chimie et Biologie des Métaux
Adresse
Laboratoire Chimie et Biologie des Métaux
CEA-Grenoble
17 avenue des Martyrs
38 054 Grenoble Cedex

 Personnel permanent impliqué dans le projet
Personnel permanent impliqué dans le projet
Geneviève Blondin, Directrice CNRS
Martin Clémancey, Ingénieur d'études Université Joseph Fourier
Richard Garcia, Maître de Conférences UJF
Jean-Marc Latour, Directeur CEA

 Personnel non permanent impliqué dans le projet
Personnel non permanent impliqué dans le projet
| Velavan Kathirvelu | Post-doc | 04/2012 - 03/2013 |
| Alexandra Sève | M2 | 01/2013 - 06/2013 |
| François Dorandeu | IUT | 04/2012 - 06/2012 |
 Présentation
Présentation
 La spectroscopie Mössbauer est utilisée avec succès en biologie pour étudier les grandes classes de protéines à fer, hémoprotéines, protéines fer-soufre, et plus récemment les protéines à fer non hémique. Jusqu'à une période récente, de telles études étaient réalisées essentiellement dans des laboratoires américains et allemands.
La spectroscopie Mössbauer est utilisée avec succès en biologie pour étudier les grandes classes de protéines à fer, hémoprotéines, protéines fer-soufre, et plus récemment les protéines à fer non hémique. Jusqu'à une période récente, de telles études étaient réalisées essentiellement dans des laboratoires américains et allemands.
Depuis quelques années, nous avons développé la spectroscopie Mössbauer pour des études en biologie et en chimie pour atteindre trois types principaux d'objectifs :
• la caractérisation de la structure électronique de sites à fer dans de nouvelles protéines et des complexes modèles,
• le piégeage et la caractérisation d'espèces réactives participant à des cycles catalytiques d'enzymes à fer,
• le fonctionnement de protéines à fer in vivo, c'est à dire en considérant le système naturel dans son ensemble.
L'étude de systèmes chimiques modèles des sites enzymatiques est développée afin de disposer de références spectroscopiques dont l'étude moléculaire peut être affinée en raison de leur taille réduite.
 Résultats récents et études en cours
Résultats récents et études en cours

 Caractérisation de nouvelles protéines
Caractérisation de nouvelles protéines
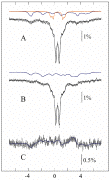 Cette activité préalable aux études de réactivité est mise en jeu aussi bien sur des systèmes de l'équipe que dans des collaborations. La figure M1 présente le spectre de la protéine MiaE isolée.
Cette activité préalable aux études de réactivité est mise en jeu aussi bien sur des systèmes de l'équipe que dans des collaborations. La figure M1 présente le spectre de la protéine MiaE isolée.
Figure M1 : Spectres Mössbauer de MiaE isolée d'un lysat. Les spectres ont été enregistrés à 4,2 K dans un champ magnétique de
A) 0,60 mT appliqué parallèlement au rayonnement gamma, ou
B) 0,22 mT appliqué perpendiculairement au rayonnement gamma. Le spectre C) est obtenu par soustraction de A et de B. Les lignes noire sont des simulations de l'Hamiltonien de spin. Les lignes colorées sont les contributions des clusters oxodiferriques (orange) et des clusters à valence mixte Fe(II)Fe(III) (bleu). La contribution des espèces majoritaires oxodiferriques (doublet central) n'est pas montrée.

 Piégeage et caractérisation d'espèces actives
Piégeage et caractérisation d'espèces actives
Les études de réactivité sont principalement focalisées sur la caractérisation de la structure électronique d'espèces fer(III)-peroxo et fer(IV)-oxo qui sont des intermédiaires dans les réactions de transfert d'oxygène par les oxygénases et les peroxydases. La figure M2 présente le spectre du composé II de la catalase de Proteus mirabilis (collaboration Hélène Jouve, IBS-Grenoble). Ce spectre révèle la présence de deux espèces FeIV : une possédant un ligand oxo (FeIV=O, spectre b), l'autre un ligand hydroxo (FeIV-OH, spectre a). Les deux espèces sont clairement distinguées par leurs paramètres Mössbauer (FeIV=O : δ = 0,07(2) mm/s, Δ
EQ = 1,47(2) mm/s ; FeIV-OH : δ
= 0,03(2) mm/s, Δ
EQ = 2,29(2) mm/s).
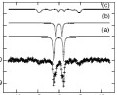 Figure M2 : Spectre Mössbauer de la catalase de Proteus mirabilis à pH 8,3 après additions d'acides peracétique et ascorbique. Le spectre a été enregistré à 4,2 K avec un champ parallèle appliqué de 50 mT.
Figure M2 : Spectre Mössbauer de la catalase de Proteus mirabilis à pH 8,3 après additions d'acides peracétique et ascorbique. Le spectre a été enregistré à 4,2 K avec un champ parallèle appliqué de 50 mT.
Dans les oxygénases et leurs modèles chimiques les espèces FeIV=O sont généralement très instables et leur isolement demeure très souvent un défi. La spectroscopie Mössbauer constitue la méthode de choix pour identifier ces espèces qui possèdent des paramètres très distinctifs. La figure M3 illustre le spectre d'une telle espèce capable d'oxyder divers substrats organiques et où le fer est complexé par un ligand polyamine (TPEN).

Figure M3 Spectre Mössbauer de [(TPEN)FeIV=O](PF6) enregistré à 4,2 K.
Paramètres Mössbauer : δ = 0,01(1) mm/s, ΔEQ = 0,87(1) mm/s.

 Étude Mössbauer in vivo
Étude Mössbauer in vivo
Des études ont débuté pour étudier les défauts d'accumulation du fer dans les mitochondries liés à l'ataxie de Friedreich.

 Analyse théorique des paramètres Mössbauer et d'Hamiltonien de spin obtenus à partir de la simulation numérique des données expérimentales
Analyse théorique des paramètres Mössbauer et d'Hamiltonien de spin obtenus à partir de la simulation numérique des données expérimentales
Une collaboration a été entreprise avec Jean-Marie Mouesca, pour évaluer à l'aide de calculs théoriques DFT, les paramètres Mössbauer et d'Hamiltonien de spin du site à fer d'une enzyme ou d'un complexe modèle à partir de sa structure cristallographique. Ces calculs théoriques ont un double but :
• l'estimation de ces paramètres dans le cas où les données Mössbauer ne sont pas disponibles dans la littérature pour des composés analogues ;
• la proposition, dans le cas ou aucune donnée cristallographique n'est disponible, de modèles structuraux de sites à fer à partir de l'analyse des paramètres issus des expériences de spectroscopie Mössbauer.
De manière plus générale, ces calculs permettent d'obtenir une description détaillée du site à fer d'un point de vue électronique, préalable à la compréhension de la réactivité de l'enzyme.
 Collaborations
Collaborations

 Protéines à fer :
Protéines à fer :
Marc Fontecave (Laboratoire de Chimie et Biologie des Métaux, CEA Grenoble), Mohamed Atta (LCBM, CEA Grenoble), Vincent Nivière (LCBM, CEA Grenoble), Jalila Simaan, Marius Réglier, Université Paul Cézanne, Marseille

 Études Mössbauer « in vivo » :
Études Mössbauer « in vivo » :
E. Lesuisse, Institut Jacques Monod, Université Paris VI

 Complexes modèles Fer(IV)-oxo :
Complexes modèles Fer(IV)-oxo :
Jean-Jacques Girerd, Frédéric Banse, Institut de Chimie Moléculaire et des Matériaux d'Orsay

 Calculs théoriques :
Calculs théoriques :
Jean-Marie Mouesca, Laboratoire de Chimie Inorganique Biologique, CEA Grenoble

 Polymères et catalyseurs :
Polymères et catalyseurs :
Adam Pron, Structure et Propriétés d'Architectures Moléculaires, CEA Grenoble.
Haut de page