V. Nivière, C. Caux
La compréhension des mécanismes catalytiques de systèmes enzymatiques originaux en relation avec leurs fonctions au sein des cellules représente un défi majeur en biologie moderne. Dans ce cadre, nos recherches se concentrent sur des études moléculaires et structurales de deux systèmes enzymatiques différents impliqués dans les processus de détoxification cellulaire :
• Superoxyde réductase SOR, une métalloenzyme impliquée dans la lutte contre le stress oxydatif
• MsrPQ, un nouveau système récemment découvert pour la réparation des résidus de méthionine oxydés, permettant une résistance bactérienne au stress d'acide hypochloreux (HOCl).
La Superoxyde réductase SOR : intermédiaire réactionnel Fe3+-OOH et formation d’espèce Fer-oxo à haut degrés d’oxydation
Certaines bactéries anaérobies et microaérophiles tolèrent la présence d'oxygène grâce à une enzyme antioxydante, la superoxyde réductase (SOR). Découverte en 2000 par notre équipe, la SOR catalyse la détoxification du radical superoxyde O
2•-, une forme réactive de l'oxygène, par une réduction à un électron :
O2•- + 1 e- + 2 H+→ H2O2 (SOR)
La SOR est une petite métalloprotéine de 14 kDa. Son site actif consiste en un centre de fer mononucléaire non-hémique atypique, coordonné par quatre atomes d’azote d'histidines dans un plan équatorial et un atome de soufre d'une cystéine en position axiale (Figure 1):
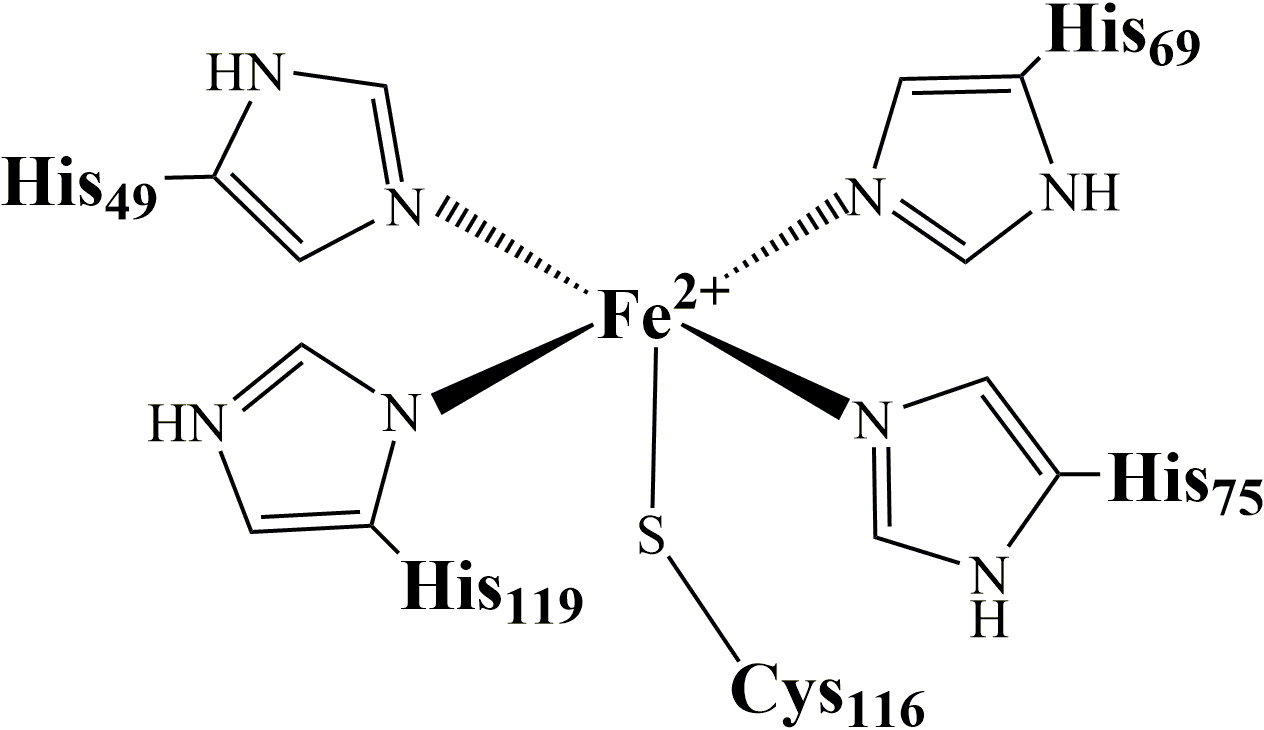
Figure 1 : site actif de la SOR.
Dans l'état Fe
2+, la sixième position de coordination est libre. C’est à ce niveau que se fixe le superoxyde pour être réduit en H
2O
2. Ce mécanisme de réduction par sphère interne conduit à la formation d’un intermédiaire de type fer ferrique hydroperoxyde (Fe
3+-OOH), résultant du transfert d'un électron du Fe
2+ vers le superoxyde et d’un processus de protonation.
Nous avons réussi à piéger cet intermédiaire en mutant des résidus d'acides aminés de la seconde sphère de coordination, ce qui a permis sa stabilisation. L'intermédiaire a été caractérisé par résonance Raman et sa structure a été résolue par diffraction des rayons X. Ce travail a été publié dans la revue
Science (
Science, 2007,
316(5823): 449-453):
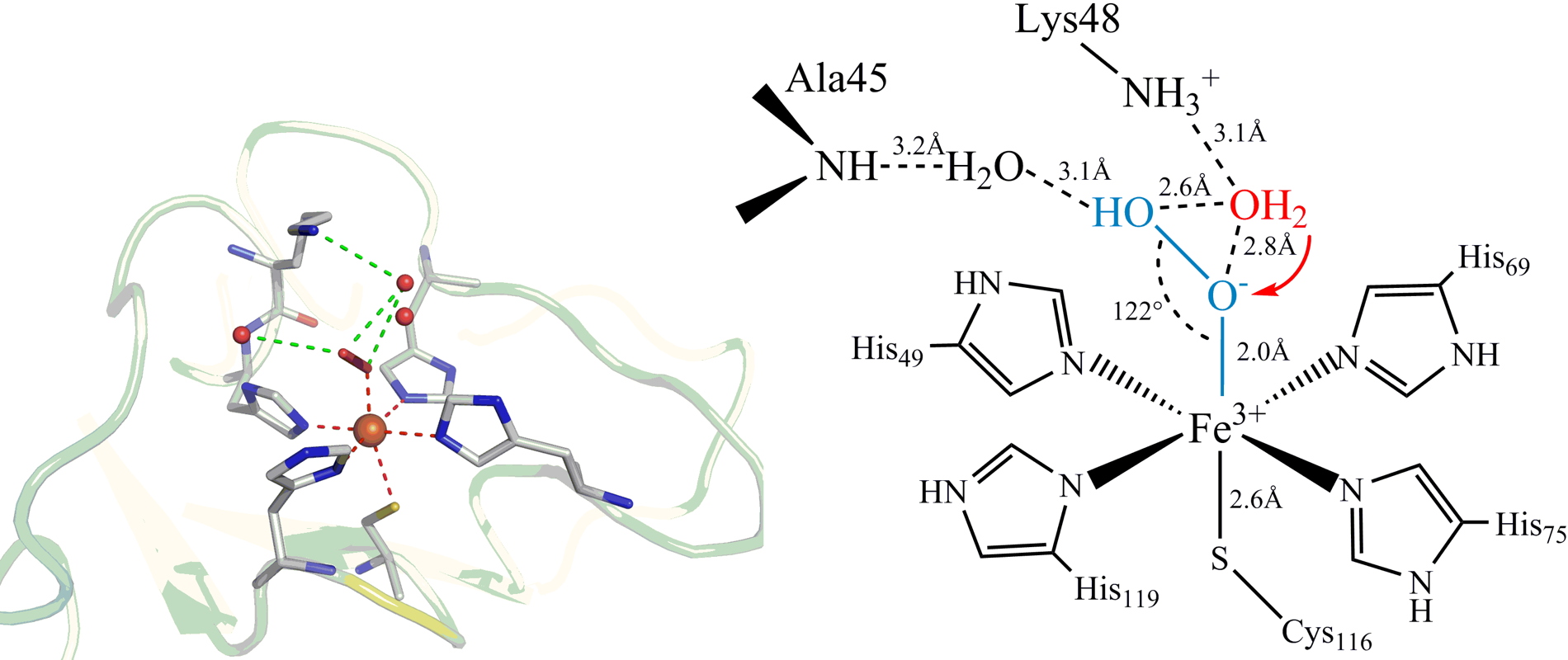
Figure 2 : Structure RX à une résolution de 1,9 Å de l'intermédiaire Fe
3+-OOH piégé dans le site actif de SOR.
La structure RX suggère notamment l'implication de la lysine 48 dans la protonation de l'oxygène proximal du Fe
3+-OOH pour former le produit final H
2O
2. Cette deuxième étape de protonation apparaît comme un des points clés du mécanisme de réduction du superoxyde par la SOR.
Katona G, Carpentier P, Niviere V, Amara P, Adam V, Ohana J, Tsanov N and Bourgeois D. Raman-assisted crystallography reveals end-on peroxide intermediates in a nonheme iron enzyme.
Science, 2007,
316(5823): 449-453
Contrôle de l’évolution de l’intermédiaire Fe3+-OOH et formation d’une espèce Fer-oxo dans la SOR Le site actif de la SOR présente des similitudes remarquables avec celui des oxygénases de type cytochrome P450 : (i) la coordination du fer est identique pour ces deux enzymes, de type FeN
4S
1, avec une même géométrie ; (ii) ces deux enzymes forment un même intermédiaire réactionnel Fe
3+-OOH au cours de leur cycle catalytique.
Cependant, dans le cas des oxygénases, l'intermédiaire Fe
3+-OOH est clivé entre ses deux atomes d'oxygène pour former une entité hautement réactive, une espèce de Fer-oxo (Fe=O) à haut degrés de valence. Ce Fe=O est capable d'oxyder des liaisons chimiques particulièrement stables au sein de différents substrats. Par contre, dans le cas de la SOR, le clivage de l'intermédiaire Fe
3+-OOH se produit entre l'atome de fer et l'oxygène proximal pour former le peroxyde d'hydrogène :
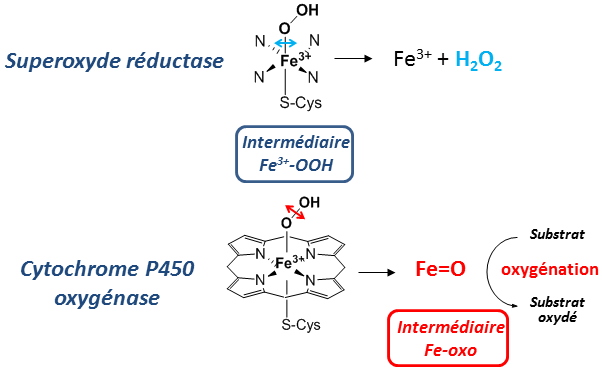
Figure 3 : Comparaison des sites actifs de la SOR et du cytochrome P450 et différence dans l’évolution de leur intermédiaire Fe
3+-OOH.
La question est donc de savoir quels sont les facteurs qui guident le sort de l'intermédiaire Fe
3+-OOH dans ces deux systèmes. Est-ce la présence de l'hème dans le cytochrome P450 ou d'autres éléments, tels que des résidus de la seconde sphère de coordination, pourraient-ils jouer un rôle prépondérant ?
C’est sur cette problématique que nous travaillons sur la SOR et actuellement nous étudions le rôle de l'environnement protéique dans l'évolution de l'intermédiaire Fe
3+-OOH.
Des données antérieures suggèrent que la lysine 48 pourrait être impliquée dans la protonation de l'oxygène proximal de l'intermédiaire. De même, l'isoleucine 118, dont le NH peptidique forme une liaison hydrogène avec le soufre ligand de la cystéine, pourrait moduler les propriétés de l’espèces Fe3+-OOH par effet trans.
Par résonance Raman, nous avons montré que la mutation de chacun de ces deux résidus conduit à la formation d'une espèce Fer-oxo dans le site actif de SOR (Figure 4) :
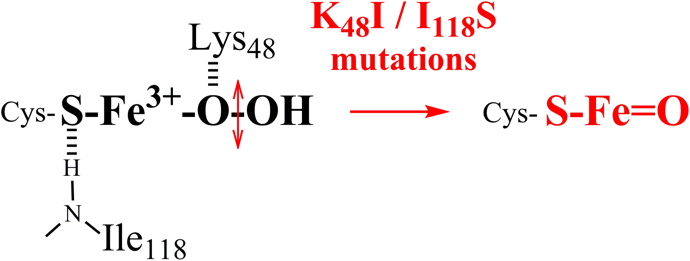
Figure 4 : Des mutations de l’environnement du fer de la SOR conduisent à la formation d’une espèce Fer-oxo.
Ces résultats montrent l'importance de la seconde sphère de coordination du site ferrique de la SOR dans le contrôle de l'évolution de l'intermédiaire Fe
3+-OOH.
Ce travail se poursuit selon deux axes complémentaires :
• Développement de calculs théoriques QM-MM afin de mieux comprendre les éléments qui conduisent à la formation d’une espèce Fer-oxo dans la SOR.
• Études d’autres résidus de la seconde sphère de coordination pour leur rôle dans l’évolution de l’intermédiaire Fe
3+-OOH.
Outre l'intérêt de comprendre le mécanisme catalytique de la SOR, ce travail ouvre aussi des perspectives importantes pour une caractérisation détaillée des mécanismes d'activation de l'oxygène et de catalyse d'oxydation.
 Collaboration
Collaboration Pr. Anne Milet, Groupe Spectrométrie, Interactions, Chimie Théorique, Département de Chimie Moléculaire Université Grenoble Alpes, Grenoble
 Publications
David R, Jamet H, Niviere V, Moreau Y and Milet A
Publications
David R, Jamet H, Niviere V, Moreau Y and Milet A Iron hydroperoxide intermediate in superoxide reductase: Protonation or dissociation first? MM dynamics and QM/MM metadynamics study.
Journal of Chemical Theory and Computation, 2017,
13(6): 2987-3004
Bonnot F, Tremey E, von Stetten D, Rat S, Duval S, Carpentier P, Clémancey M, Desbois A and Nivière V Formation of high-valent iron-oxo species in superoxide reductase: Characterization by resonance Raman spectroscopy.
Angewandte Chemie International Edition, 2014,
53(23): 5926-5930
Rat S, Ménage S, Thomas F and Nivière V Non-heme iron hydroperoxo species in superoxide reductase as a catalyst for oxidation reactions.
Chemical Communications (Camb), 2014,
50(91): 14213-14216
MsrPQ : un nouveau système de réparation des méthionines oxydées, impliqué dans la résistance bactérienne à HOCl.
L’acide hypochloreux HOCL est une espèce chimique très oxydante qui se révèle être particulièrement toxique pour les microorganismes. Il constitue d’ailleurs le composé actif de l’eau de Javel.
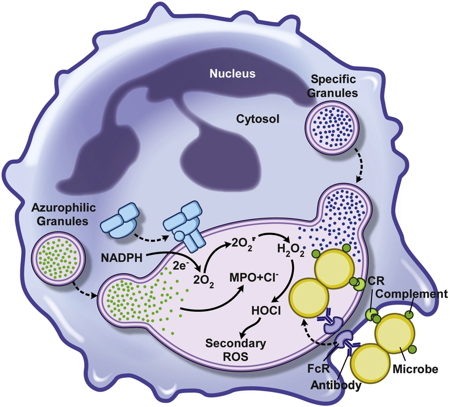
La production d’HOCL est aussi la première ligne de défense utilisée par le système immunitaire inné pour détruire les bactéries et autres microorganismes pathogènes. Après phagocytose des pathogènes par les neutrophiles ou les macrophages, l’activation de la NADPH oxydase NOX conduit à une production massive intra-phagosomale d’HOCl, qui constitue le mécanisme principal pour éliminer les pathogènes (Figure 5).
Figure 5 : Activité microbicide de neutrophile après phagocytose.
On sait que les cibles principales d’HOCl sont les méthionines des protéines bactériennes qui sont massivement oxydées en méthionine sulfoxyde (Met-S=O). Ce type d’oxydation entraîne une forte altération de la structure des protéines, induisant la perte de leur activité ainsi que de leur fonction. Rapidement ce processus conduit à la mort du pathogène.
Très récemment, en 2015, il est apparu que certaines bactéries expriment un tout nouveau type de méthionine sulfoxyde réductase (Msr) capable de neutraliser l'effet de l’HOCl en réparant les méthionines oxydées. La singularité de cette nouvelle activité Msr, appelée MsrPQ, réside en trois points principaux (Figure 6) :
i) Présence d’un cofacteur molybdène dans le site actif de MsrP, alors que toutes les Msr caractérisées jusqu'à présent ne contenaient pas de métal et fonctionnaient selon une chimie impliquant un résidu de cystéine.
ii) Localisation périplasmique.
iii) Association spécifique avec un cytochrome membranaire, appelé MsrQ, codé au sein d’un même opéron avec MsrPP.
Avec ce système multienzymatique MsrPQ, les bactéries sont capables de reverser l’effet toxique de HOCl sur les protéines périplasmiques, qui sont principalement touchées en cas de stress HOCl.
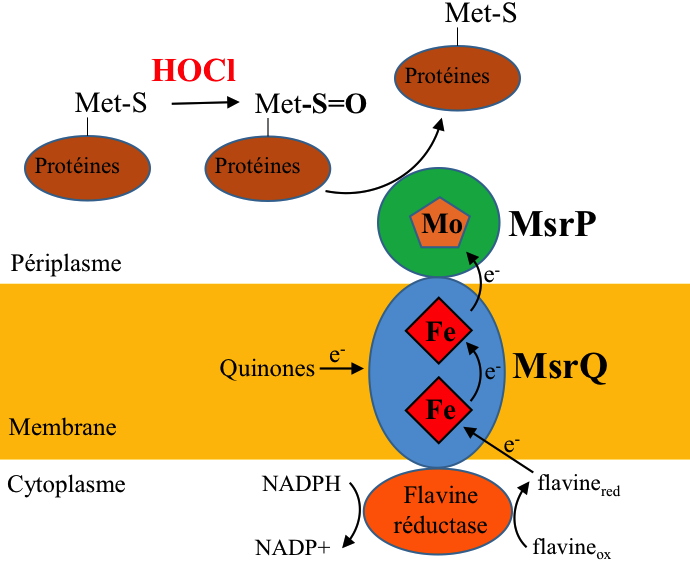
Figure 6 : Hypothèse sur l’organisation et le fonctionnement du système MsrPQ pour la réparation des méthionines oxydées (Met-S=O) par HOCl.
De façon tout à fait intéressante, certaines bactéries pathogènes intracellulaires présentent dans leurs génomes une duplication de cet opéron MsrPQ dans des régions de l’ADN associées à des îlots de pathogénicité. Cela suggère que la duplication de cet opéron pourrait avoir un rôle important pour la virulence de ces pathogènes.
Notre projet est de caractériser en détail ce nouveau système MsrPQ d’un point de vue moléculaire et structural et d’étudier les mécanismes de transfert d’électrons, les interactions spécifiques entre les différents partenaires, ainsi que les différents aspects qui peuvent contrôler son activité globale.
 Collaboration
Collaboration Pr Franck Fieschi, Groupe Membrane et Immunité, Institut de Biologie Structurale, 71 avenue des Martyrs, Grenoble
 Publication
Juillan-Binard C, Picciocchi A, Andrieu JP, Dupuy J, Petit-Hartlein I, Caux-Thang C, Vives C, Niviere V and Fieschi F
Publication
Juillan-Binard C, Picciocchi A, Andrieu JP, Dupuy J, Petit-Hartlein I, Caux-Thang C, Vives C, Niviere V and Fieschi F A Two-component NADPH Oxidase (NOX)-like system in bacteria is involved in the electron transfer chain to the methionine sulfoxide reductase MsrP.
Journal of Biological Chemistry, 2017,
292(6): 2485-2494