Le terme « biomatériaux » n'a longtemps désigné que des matériaux biocompatibles avec l'organisme humain ou animal. Depuis quelques années, ce terme englobe également des matériaux issus de certaines biotechnologies et constitués de polymères d'origine naturelle ou non. Actuellement, les molécules naturelles fréquemment utilisées appartiennent à la catégorie des sucres comme le chitosane, l'acide hyaluronique ou encore les alginates. Depuis plusieurs années maintenant, les matériaux basés sur des polypeptides font l'objet d'importantes recherches. Certains sont d'ailleurs présents dans la nature comme la nacre, les soies ou encore la laine. Les propriétés d'auto-assemblage de ces biopolymères du nano au macroscopique, les rendent particulièrement prometteurs pour l'approche bottom-up utilisée généralement dans le cadre de la conception de nanomatériaux. En effet, les interactions dans et entre les polypeptides sont toutes de faibles énergies (liaisons hydrogènes, ioniques, interactions hydrophobes et forces de van der Waals), mais leur effet cumulatif au sein de structures ordonnées peut aboutir à des objets très stables. Actuellement, de nombreuses recherches portent sur l'utilisation de peptides de synthèse présentant effectivement des propriétés propices à l'auto-assemblage supramoléculaire. Malgré les problèmes soulevés par cette technologie (longueur de la séquence et coûts de production), un certain nombre de matériaux ont déjà vu le jour et notamment sous la forme d'hydrogels destinés principalement à la culture cellulaire en trois dimensions ou au transport de molécules actives.
Dans notre équipe, nous nous intéressons à l'auto-assemblage de protéines qui peut aboutir à des structures variées et stables et donc également former une large palette de biomatériaux. Les protéines utilisées sont issues de biotechnologies qui reposent sur la production de protéines hétérologues par des organismes génétiquement modifiés. Une de nos autres stratégies est de travailler avec des protéines naturelles par exemple, les protéines du lait. Certaines protéines du lait comme l'α-lactalbumine peuvent s'auto-assembler pour former divers objets en fonction des conditions utilisées (Figure 2). Par exemple, à haute température, elle est capable d'interagir avec le lysozyme, pour former à l'échelle du micromètre, des microsphères poreuses utilisables par exemple pour la délivrance de molécules bioactives (thèse de Delphine Salvatore). Dans d'autres conditions, l'α-lactalbumine est également capable de s'auto-assembler pour former des fibres de plusieurs centaines de nanomètres de long (Figure 2, en haut à gauche) qui peuvent ensuite grandir jusqu'à plusieurs dizaines de micromètres si elles sont placées en présence de liposomes (Figure 2, en bas à gauche). D'autres assemblages sous forme de nanotubes, s'obtiennent par protéolyse partielle de la protéine (Figure 2, en bas à droite). Ces nanotubes sont capables d'interagir et de s'organiser pour former des hydrogels.
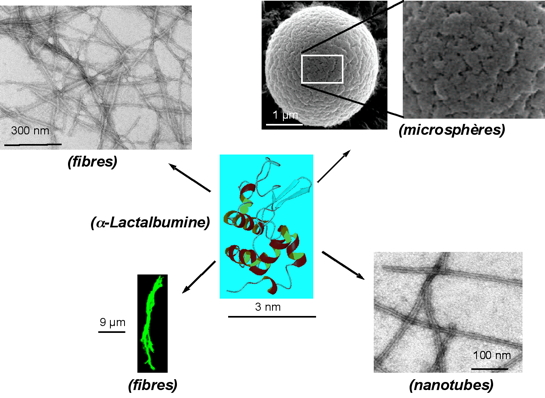
Figure 2. Variété de matériaux obtenus par auto-assemblage d'une protéine. La topologie de la chaîne polypeptidique de l'α-lactalbumine est représentée au centre de la figure. Les chaînes latérales ne sont pas reportées. Les hélices α sont colorées en rouge/jaune et le feuillet ß en bleu. La sphère verte est un ion calcium fixé à la protéine. Les différents matériaux obtenus par auto-assemblage de cette protéine sont décrits dans le texte.