La nécessité croissante de développer une chimie plus respectueuse de l’environnement pousse au développement de catalyseurs dits « verts », capables de réaliser entre autre des réactions d'oxydation de substrats organiques en utilisant des sources d’atomes d’oxygène elles-mêmes non toxiques, peu onéreuses et abondantes. De fait, l’utilisation du dioxygène comme oxydant est une formidable alternative car elle rassemble ces prérequis. Or, de par sa relative stabilité chimique, cette molécule doit être activée.
Dans la Nature, ceci est souvent réalisé par un cation métallique dans son état réduit. S’inspirant de ce processus, l’élaboration de catalyseurs d'oxydation associant au sein d'une même entité un fragment catalytique à base de cuivre (siège de la réaction d’oxydation) et une partie photosensible capable de régénérer l’état actif réduit du site catalytique, ouvre des perspectives innovantes dans le domaine de la chimie environnementale. Le cuivre à l’état réduit est, avec le fer, le cation métallique le plus utilisé par les métalloenzymes pour activer le dioxygène. Une fois la réaction d’oxydation effectuée, il se retrouve à l’état oxydé. Des réductases se chargent alors de régénérer l’état réduit. Les chercheurs de notre laboratoire, en se basant sur la capacité des systèmes photosynthétiques à réaliser des réactions de transfert d’électrons photo-induits, ont développé une stratégie consistant à associer à un complexe de cuivre (centre catalytique d’oxydation), un photosensibilisateur permettant d’initier le transfert d’électron nécessaire à l’activation d’O
2 par le cuivre.
Pour cela, ils ont développé (
Figure) un complexe hétérodinucléaire combinant au sein de la même entité un chromophore à base de ruthénium et une entité catalytique à base de cuivre. Ce système a montré des capacités photocatalytiques particulièrement intéressantes lors de l’oxydation de divers substrats en utilisant O
2 comme seule source d’atome d’oxygène en présence d’un donneur d’électron sacrificiel. Plus particulièrement, il a été mis en évidence un transfert d’électron du chromophore vers le centre cuivre permettant ainsi la réduction de ce dernier alors en mesure de réagir avec le dioxygène.
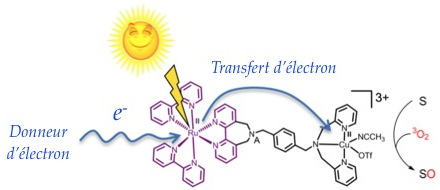
En présence d'un donneur d'électrons, l'irradiation lumineuse du photosensibilisateur déclenche un transfert d'électrons du chromophore vers la partie catalytique permettant l’activation du dioxygène. La nouvelle espèce ainsi formée est alors en mesure de réaliser l’oxydation de divers substrats organiques par transfert d’atome d’oxygène issu de O2.
S = Sulfures, Alcènes, Phosphines
Cependant chacun de ces systèmes nécessite soit un donneur, soit un accepteur d’électron sacrificiel ce qui, dans l’objectif de développer une chimie de plus en plus respectueuse de l’environnement pose un problème important en terme d’économie d’atomes et d’électrons. Par conséquent, ces chercheurs ont désormais comme projet d’associer les deux types de photocatalyseurs afin de s’affranchir totalement de la présence d’autres réactifs que le substrat et d’utiliser à la fois l’eau et le dioxygène pour réaliser simultanément deux réactions d’oxydation.