Une métalloenzyme artificielle (ArM) est un édifice hybride fruit de l’insertion d’un complexe inorganique de synthèse au sein d’une biomolécule de type ADN ou protéine. L’ensemble forme un catalyseur éco-compatible qui fonctionne dans des conditions douces en accord avec les principes de la chimie verte. Toutefois, un pas supplémentaire peut être franchi en proposant ces catalyseurs en version hétérogène (liquide-solide).
Nous concevons des ArM dans le but de proposer de nouvelles méthodologies de catalyse durable pour des réactions d’oxydation. Dans ce cadre, nous avons mis au point plusieurs systèmes performants à base notamment de la protéine NikA (une protéine de transport du nickel sans propriété enzymatique) et de complexes de fer et de ruthénium. Toutefois, les ArM peuvent encore être améliorées dans le but d’élargir la gamme de substrat (limitée par la solubilité en phase aqueuse), le nombre de cycles catalytiques (limité par la stabilité des protéines en milieu oxydant) et la diversité des réactions (volonté d’accéder à des combinaisons de processus catalytiques).
Pour atteindre ces objectifs, nous avons choisi de créer une version hétérogène originale d’ArM. Ce travail a pu être réalisé grâce à la stabilisation de cristaux de la protéine NikA par réticulation (Cross-Linked Enzyme Crystal : CLEC). Une première étape a consisté en la mise au point de conditions de réticulation de cristaux d’ArM adaptées à une production conséquente de cristaux catalytiques (ArM-CLEC) liée à l’utilisation de 50 à 100 cristaux par expérience. Puis, les ArM-CLEC étant stables dans des mélanges eau-solvant organique (de 4 à 70°C et en présence de nombreux oxydants), leurs propriétés catalytiques ont pu être testées. Une efficacité comparable à celle d’une enzyme "naturelle" a été mise en évidence notamment en ce qui concerne la réaction de coupure oxydante de dérivés du styrène (
Figure).
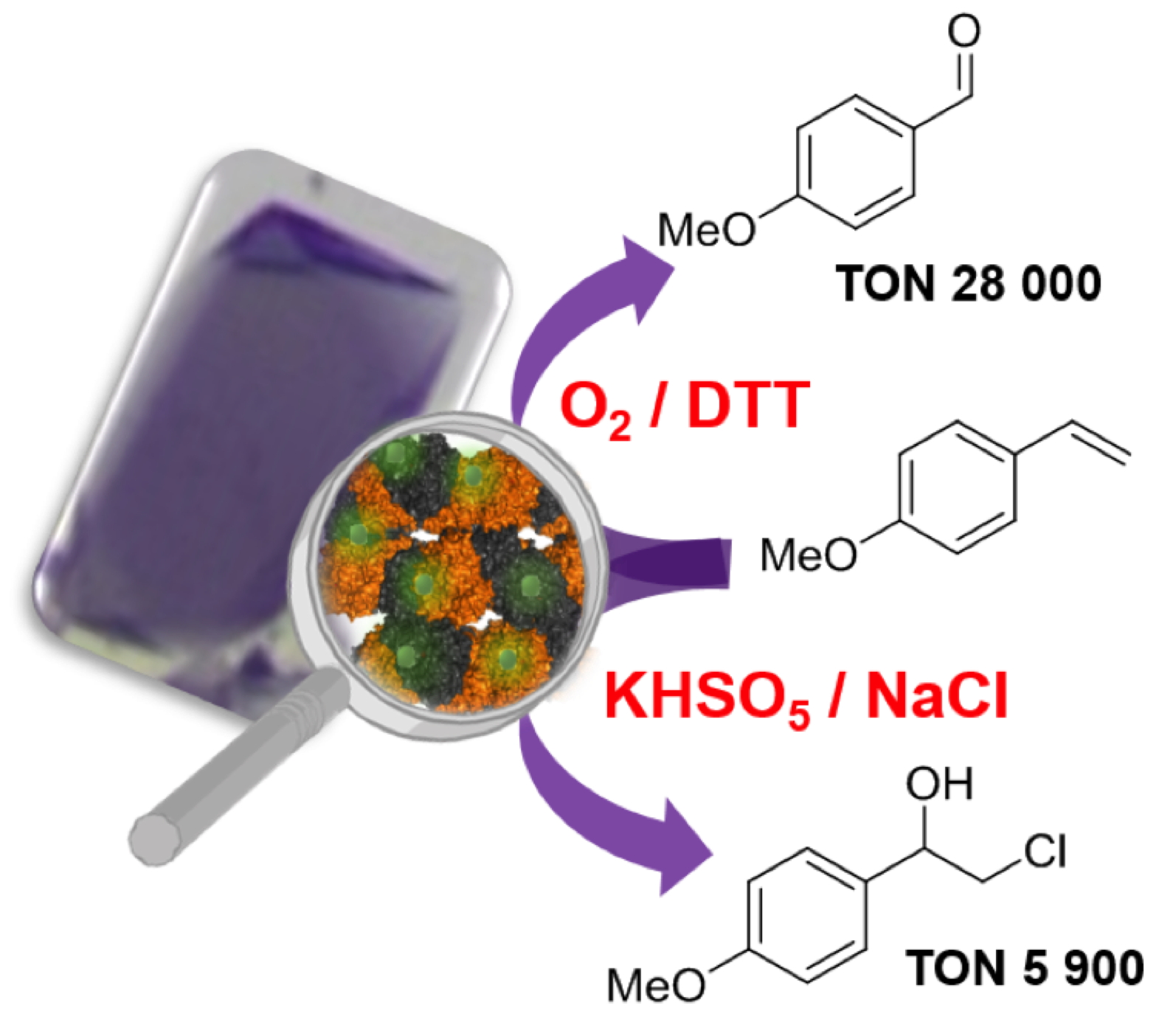
Un cristal d’ArM-CLEC est constitué d’hybrides NikA-FeL2 (FeL2 étant un complexe de fer avec un ligand phénolate qui confère la couleur violette aux cristaux) réticulés avec du glutaraldéhyde. La stabilité des cristaux dans un mélange de solvant eau-acétonitrile 1-1 permet d’employer de nombreux substrats lipophiles et de tester des réactions d’oxydations variées, ici coupure oxydante et hydroxychloration.
Ainsi, l’aldéhyde correspondant a pu être obtenu avec plus de 28 000 TON (Turnover number) grâce à 50 étapes de recyclage réalisées avec le même ensemble de cristaux, gage de la stabilité du matériel hétérogène. À titre de comparaison, l’hybride en conditions de catalyse homogène ne conduit qu’à 140 TON. La grande originalité de ce catalyseur hybride solide est donc de permettre la stabilisation du site catalytique artificiel au sein du cristal de protéine.
Nous avons désormais pour but de proposer des systèmes catalytiques encore plus éco-compatibles et combinant différents catalyseurs. Cette étude illustre la puissance de l’association des catalyses homogène, hétérogène et biologique.
Ce travail regroupe des études de synthèse, de catalyse et de cristallographie des protéines. Il résulte d’une collaboration entre deux équipes du laboratoire Chimie et Biologie des Métaux : l’équipe Catalyse Bioinorganique et Environnement et l’équipe BioCatalyse.
Ces travaux sont financés par l’ANR CrystalBall et une bourse de thèse du Labex ARCANE