La transition énergétique est un enjeu majeur du XXIème siècle. Les recherches se portent vers de nouvelles sources d’énergies et de nouvelles technologie pour recycler le carbone du CO2 en hydrocarbure ou en molécules organiques à haute valeur ajoutée pour l’industrie. L'électro et la photo-réduction de l'eau en H2 ou du CO2 en molécules chimiques organiques à forte densité énergétique font partie des stratégies clés pour stocker les énergies renouvelables, en énergie chimique disponible à volonté (l'énergie contenue dans les liaisons chimiques). Le développement de cette technologie nécessite la mise au point de nouveaux catalyseurs ainsi qu’une meilleure compréhension fondamentale des mécanismes multiélectroniques et multi-protéiques associés à ces réactions, afin de les améliorer pour obtenir des processus de stockage bon marché, stables, efficaces et sélectifs.
C’est dans ce contexte que des chercheurs de notre laboratoire, en collaboration avec des chercheurs du laboratoire de chimie des processus biologiques du Collège de France, ont étudié la protéine Orange (Orp) quant à ses capacités à catalyser la réduction des protons en H2. Il s’agit d’une petite protéine monomérique de 120 acides aminés contenant un cluster métallique [S2MoS2CuS2MoS2]3– original dont la fonction physiologique reste encore inconnu. Le choix de cette protéine a été dicté par la ressemblance structurale de son centre métallique et le site actif métallique de la monoxyde de carbone déshydrogénase (CODH) Mo-S-Cu, enzyme connue pour réduire le CO2 en CO.
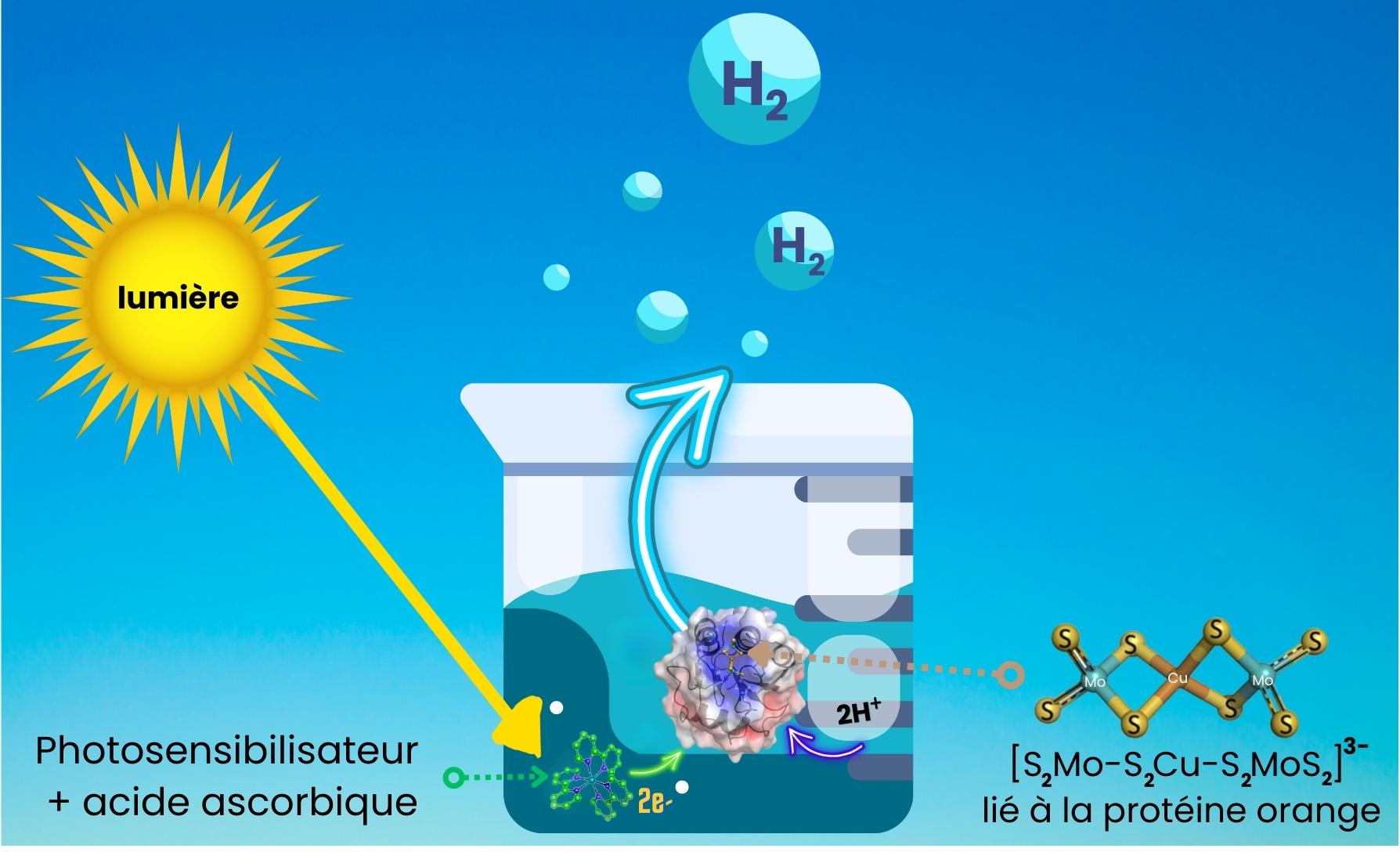
Les études menées ont montré qu’après 4 heures d'irradiation sous lumière visible en présence du photosensibilisateur [Ru(bpy)3]Cl2 et d’un donneur sacrificiel d’électrons, la protéine
Holo-Orp présentait une excellente activité photo-catalytique de production d’hydrogène pendant 890 cycles (voir
Figure).
Afin d’optimiser le système enzymatique, différents clusters de formule [S2MS2M′S2MS2](4n)– ont été inséré dans la protéine Orp et le système renfermant un cluster à base de Mo et de Fe s’est révélé comme étant le catalyseur le plus performant avec 1150 cycles catalytiques en seulement 2,5 heures, un record parmi les hydrogénases artificielles rapportées dans la littérature à ce jour.
Ces résultats constituent une avancée pour de futures applications biotechnologiques.
 Figure
: Production de H2 après irradiation de la protéine
Holo-Orp en présence du photosensibilisateur [Ru(bpy)3]2+ et du donneur sacrificiel d’électrons.
Figure
: Production de H2 après irradiation de la protéine
Holo-Orp en présence du photosensibilisateur [Ru(bpy)3]2+ et du donneur sacrificiel d’électrons.