Les équipes BioCE du LCBM et I2BM du Département de Chimie Moléculaire travaillent au développement de nouvelles métalloenzymes artificielles comme catalyseurs de réactions d’oxydation. Les métalloenzymes artificielles sont des catalyseurs issus de la combinaison d’une biomolécule, dont le rôle est d’assurer la stabilité et la sélectivité de l’hybride, et d’un catalyseur inorganique, dont le rôle est d’assurer la réactivité choisie. Des études antérieures ont montré que des hybrides formés à partir de la protéine NikA et de divers complexes de fer permettent de catalyser des réactions d’oxydation d’alcènes ou de thioéthers. Toutefois, ces réactions sont faiblement énantiosélectives.
Pour cette étude, dans le but d’améliorer l’énantiosélectivité de la réaction de sulfoxydation, la protéine a été remplacée par un oligonucléotide de type G-quadruplexe, stabilisé dans une topologie unique, topologie parallèle, grâce à son ancrage sur un peptide cyclique. L’interaction entre un complexe de cuivre bipyridine et le G-quadruplexe contraint conduit à l’oxydation de dérivés du thioanisole avec un excès énantiomérique maximal de 73 % en présence d’eau oxygénée comme oxydant. Des études comparatives entre le G-quadruplexe naturel et des G-quadruplexes contraints ayant subi des modifications au niveau des tétrades externes 3’ et/ou 5’ ont permis d’identifier les différents sites réactionnels au sein de l’enzyme artificielle et de proposer un mécanisme réactionnel.
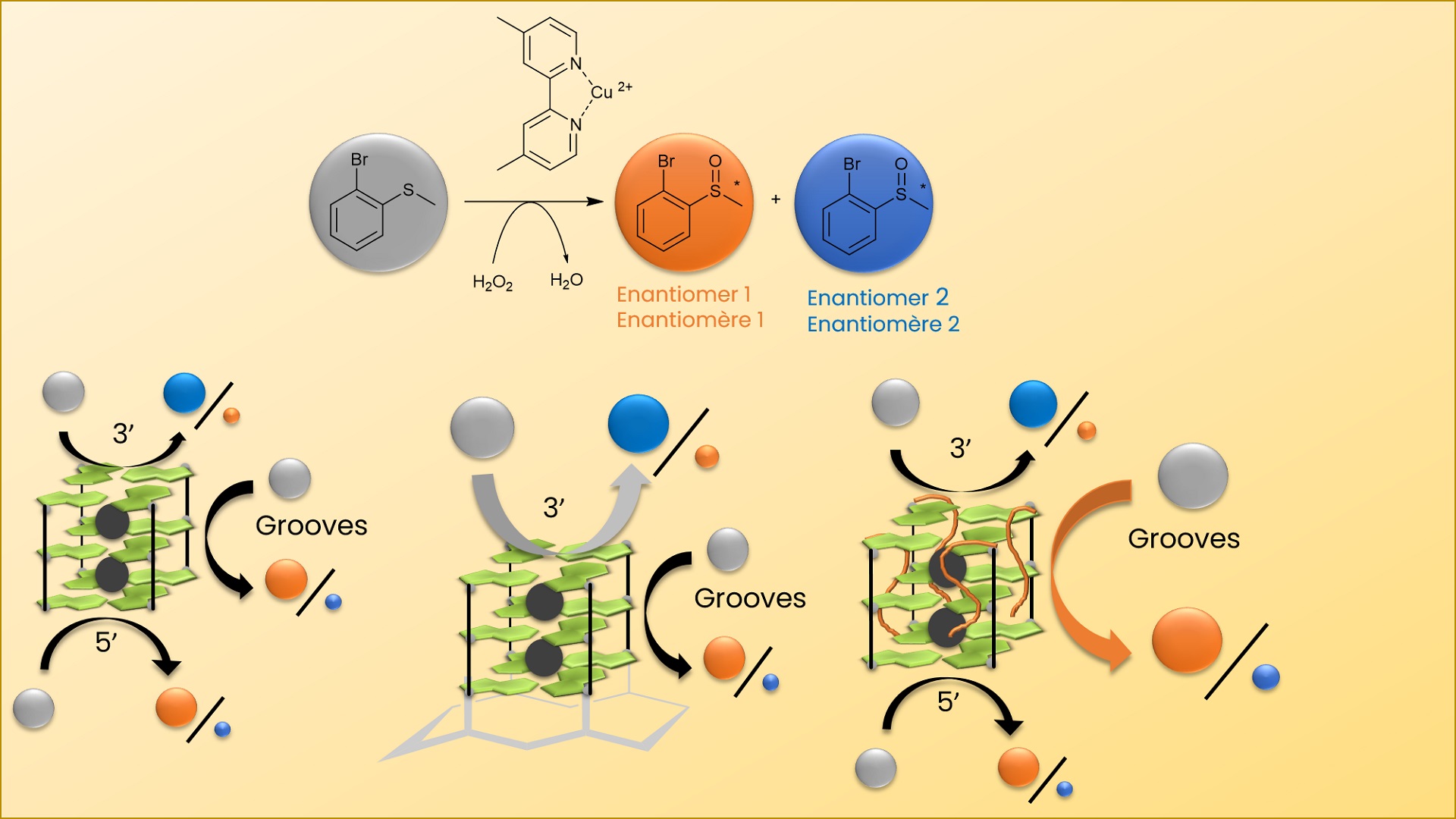
Les résultats obtenus ont permis d’expliquer le contrôle énantiosélectif de la réaction de sulfoxydation avec un catalyseur de type métalloenzyme artificielle basée sur un G-quadruplexe. Il a été mis en évidence l’importance du rôle de l’ajout de nucléosides au niveau de l’extrémité 3’.
Ces recherches ont été financées par le projet ANR CoolCat.