Une métalloenzyme artificielle (ArM) est un édifice hybride, fruit de l’insertion d’un complexe inorganique de synthèse au sein d’une biomolécule de type ADN ou protéine. Le complexe inorganique est choisi en rapport avec la réaction visée. L’ensemble forme un catalyseur dont l’emploi est recommandé dans le cadre de l’évolution vers des méthodes de synthèse éco-compatibles et qui fonctionne dans des conditions douces en accord avec les principes de la chimie verte.
Nous concevons des ArM dans le but de proposer de nouvelles méthodologies de catalyse pour des réactions d’oxydation. Dans ce cadre, nous avons mis au point plusieurs systèmes performants à base notamment de la protéine NikA (une protéine de transport du nickel sans propriétés enzymatiques) et de complexes de fer (un métal physiologique non toxique). Les ArM peuvent également être créées à partir de métaux non-physiologiques et employées dans le but de réaliser des réactions que les enzymes natives ne savent pas faire.
Pour illustrer cette thématique, nous avons choisi, en collaboration avec le Pr Burzlaff, Université Friedrich Alexander (Allemagne), de travailler avec un complexe de ruthénium. Ce complexe est un catalyseur d’époxydation des alcènes en milieu organique dont le manque d’efficacité est dû à sa dégradation rapide dans le milieu réactionnel. Afin d’en augmenter la stabilité, nous l'avons associé à la protéine NikA. Nous avons ensuite caractérisé d’un point de vue structural ce premier hybride à base de Ru, puis déterminé ses propriétés catalytiques. Cette nouvelle ArM s’est montrée extrêmement intéressante puisque, en plus de la stabilisation attendue, l’activation du complexe par la protéine a conduit de façon inattendue à la production sélective et spécifique de chlorhydrines (
Figure) en lieu et place des époxydes attendus. Cette ArM présente donc une réactivité unique et jamais décrite chez les enzymes artificielles et natives. De plus, et contrairement à une enzyme native, l’ArM accepte une large gamme de substrats présentant une double liaison plus ou moins activée et un encombrement stérique variable, offrant ainsi potentiellement un plus grand nombre d’applications.
Nous avons désormais pour but de rendre cette réaction chimique attractive d’un point de vue industriel et de proposer un catalyseur totalement éco-compatible en modifiant l’oxydant utilisé, un dérivé d’iode encore trop toxique. Cette étude illustre la puissance de l’association d’une protéine et d’un cœur catalytique synthétique et illustre le potentiel des nanosciences dans le domaine de la biocatalyse.
Ce travail regroupe des études de synthèse et de catalyse, cristallographie, biochimie et modélisation moléculaire et résulte d’une collaboration entre quatre équipes du laboratoire Chimie et Biologie des Métaux : BioCE, BioCat, BioMet et MCT. Il est financé par l’ANR CrystalBall et une bourse de thèse du Labex ARCANE.
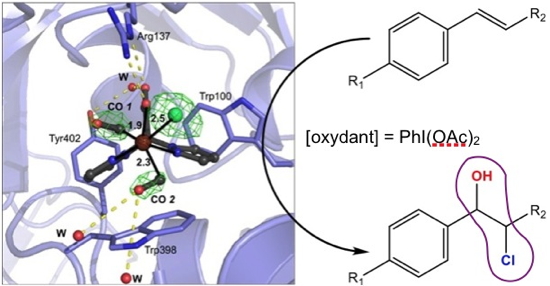
La coordination du complexe au sein de la protéine via des interactions supramoléculaires provoque le départ d’un des groupements CO, observé par diffraction des rayons X, rendant possible l’entrée de l’oxydant dans la sphère de coordination du métal et donc l’activation dudit oxydant. Sur cette image, on peut voir le groupement CO 2 sur le point d’être libéré.
En violet le motif Chlorhydrine.