La biocatalyse et la catalyse homogène deviennent aujourd’hui les solutions incontournables pour la synthèse de produits chimiques, d’intermédiaires de l’industrie de la santé, de l’agriculture et de l’industrie alimentaire, dopées par la pression sociétale liée à la protection de l’environnement. Pourtant, le nombre et la diversité de leurs applications restent modestes, sans doute en partie à cause du faible nombre d’enzymes pour la biocatalyse et de la faible stabilité des catalyseurs homogènes. Néanmoins, les chercheurs et les industriels s’accordent à dire que la biocatalyse et la catalyse homogène sont deux domaines de recherche porteurs pour les technologies de développement durable. En fait, ces deux domaines de la catalyse sont complémentaires en termes de performances et les avantages de l’un sont les désavantages de l’autre [Référence].
Par conséquent, il existe aujourd’hui une stratégie innovante qui consiste à combiner les deux domaines et créer des métalloenzymes artificielles. Leur structure est issue des deux mondes : le site actif provenant de la chimie inorganique, est inséré dans une structure protéique inactive. Le concept est simple et ouvre des solutions à l’infini : le complexe inorganique dicte la nature de la réaction (jouant le rôle du site actif de l’enzyme) et l’échafaudage protéique va dicter la sélectivité de la réaction. Les potentialités de ces nano-hybrides relèvent à la fois du domaine du fondamental et de la recherche et développement. L’optimisation de réactions sera grandement facilitée par les possibilités de l’évolution dirigée par la mutagenèse rationnelle liée à la chimiogenèse (modification de la partie organique du complexe).
En collaboration avec le LCCP de l’IBS, nous sommes impliqué depuis 2006 à la mise au point de monooxygénases artificielles, dont la fonction est basée sur le transfert d’atome d’oxygène, en visant des réactions énantiosélectives. Les verrous technologiques actuels sont basés sur le mode d’insertion spécifique du complexe inorganique au sein de la protéine (liaisons covalentes ou supra-moléculaires). Depuis les années 2000, les travaux dans le domaine émergent mais restent encore au stade des balbutiements. Deux exemples d’hybrides vont illustrer les potentialités de ce domaine :
Une métalloenzyme artificielle compétitive
L’oxydation de sulfures en sulfoxides chiraux (création d’un liaison S-O) représente une étape cruciale pour la synthèse de médicaments.
Nous avons réalisé un hybride constitué par l’insertion d’un complexe de manganèse dans l’albumine du sérum humain créant ainsi une monooxygénase artificielle. Cet hybride présente une réactivité originale dans l’eau et des conditions douces. Le complexe de manganèse possède une activité catalytique conduisant à la formation exclusive de sulfones. L’hybride quant à lui ne conduit qu’à la synthèse de sulfoxydes avec une efficacité nettement supérieure. Par comparaison, l’enzyme seule conduit à une faible activité peu sélective, avec la formation en quantités égales de sulfoxydes et de sulfones. Ces résultats montrent l’effet de synergie des deux constituants de la monooxygénase artificielle ainsi créée. Tout aussi exemplaire, la stabilité de l’hybride est du niveau de celle d’une enzyme, rendant alors compte de l’importance de l’insertion du catalyseur au sein de l’édifice.
Ces travaux démontrent sans ambiguïté la viabilité de tels systèmes. Il reste à ces chercheurs à obtenir des réactions énantiosélectives.
Une réactivité propre d’un complexe inorganique au sein d’une métalloenzyme : Le concept de réactivité chimique in cristallo
La principale contribution du chimiste bio-inorganicien dans le domaine de la biologie consiste en la révélation des mécanismes enzymatiques au niveau moléculaire. Les exemples sont nombreux et l’équipe Chimie Rédox Bioinspirée a participé à ces découvertes depuis de nombreuses années. La détermination d’un cycle catalytique nécessite la caractérisation de tous les intermédiaires réactionnels instables et le nec plus ultra repose sur la précision de leur structure au niveau moléculaire grâce à la diffraction des rayons-X. En chimie, la difficulté est de caractériser des espèces instables seulement piégées à très basses températures ce qui rend leur cristallisation un vrai défi. En biologie par contre, la difficulté peut être court-circuitée car, une fois la protéine cristallisée, il est envisageable de suivre la réaction enzymatique directement au sein du cristal. Ainsi, il est parfois possible de faire diffuser les substrats au sein du cristal et de suivre la réaction « in cristallo ».
Nous essayons de comprendre le mécanisme de la réaction d’hydroxylation aromatique et l’activation de l’oxygène moléculaire par des enzymes à fer. La question fondamentale est de comprendre la sélectivité de la réaction alors que le fer et l’oxygène conduisent à la génération de radicaux libres.
Nous avons élaboré un mime de la réaction via l’introduction d’un cycle aromatique au sein d’un complexe de fer. L’étude de son activation réductrice de O2 montre que le complexe est très peu modifié mais que le ligand a été oxydé. Devant l’impossibilité de cristalliser le produit de la réaction, nous avons décidé d’effectuer cette réaction au sein d’un cristal de protéine. La cristallisation de l’hybride a été effectuée, rendant possible le suivi de la réaction d’activation de l’oxygène conduisant à une hydroxylation aromatique. La divergence de la réaction à l’extérieur de la protéine et dans l’hybride illustre une nouvelle fois l’influence de l’échafaudage protéique sur la sélectivité d’une réaction (Figure).
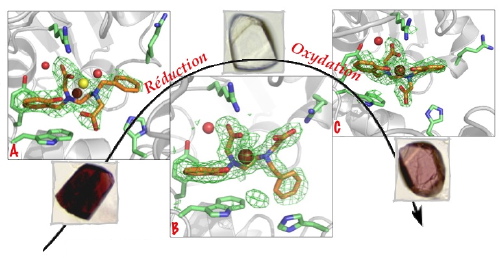
Exemple de cinétique chimique in cristallo.
A - Complexe de Fe dans un cristal de protéine
B - Changement de conformation du complexe après réduction du Fe
C - Insertion d’un oxygène dans le complexe après activation de l’oxygène moléculaire
Le concept de réactivité chimique in cristallo ouvre dès maintenant une nouvelle voie de détermination de mécanismes réactionnels de la chimie inorganique.
Le concept de métalloenzyme artificielle peut évidemment se transposer dans tous les domaines où deux constituants de fonctions bien définies conduisent à une activité ou propriété nouvelles, comme dans le cas des nanosciences.