La demande en
produits chiraux, souvent sous la forme d’un seul
énantiomère, a augmenté de façon considérable ces dernières années, particulièrement sous l’influence de l’industrie pharmaceutique mais également de l’agrochimie, de l’industrie des parfums et des matériaux. Cette demande est stimulée par deux facteurs principaux :
• Il est connu que les deux énantiomères d’un composé chiral peuvent présenter des activités biologiques drastiquement différentes. Très souvent, l’activité biologique n’est portée que par un seul énantiomère. C’est le cas de la L-DOPA utilisée dans le traitement de la maladie de Parkinson. Parfois les deux énantiomères montrent deux activités différentes : un des énantiomère du propoxyphène est analgésique alors que l’autre a des propriétés antitussives. On peut également citer la thalidomide utilisée dans les années 70 sous forme racémique comme sédatif pour les femmes enceintes. Malheureusement, alors qu’un des deux énantiomères a la propriété attendue, l’autre présente une activité tératogène responsable de nombreuses malformations congénitales.
• La seconde raison, purement commerciale, permet de prolonger la durée de vie d’un médicament racémique dont le brevet arrive en fin de validité en le commercialisant sous sa version énantiopure. C’est le «racemic switch». Beaucoup de médicaments sont encore disponibles sous forme racémique. C’est notamment le cas de la cétirizine (antihistaminique), le citalopram (antidépresseur), l’oméprazole (antiulcéreux) etc Un certain nombre est maintenant commercialisé sous la forme d’un seul énantiomère. C’est par exemple le cas de l’oméprazole, mélange racémique actuellement commercialisé sous la forme d’un seul énantiomère sous le nom d’ésoméprazole (Nexium®).
Dans ce contexte, nous avons assisté durant ces 30 dernières années à un développement remarquable des méthodes de synthèse énantiosélectives, qui ont maintenant atteint un degré élevé de diversité et de complexité. Il en est pour preuve l’attribution du prix
Nobel de chimie 2001 à Knowles, Noyori et Sharpless pour leurs travaux sur la catalyse asymétrique.
De plus en plus, les chimistes organiciens utilisent comme catalyseurs des complexes de métaux de transition dont l’élément de chiralité est porté par le ligand organique. Pourtant, c’est oublier une des caractéristiques de la majeure partie des complexes de métaux de transition. Ils possèdent en effet une chiralité inhérente à la géométrie de coordination du centre métallique (Δ et &Lambda pour les complexes octaédriques). La question de savoir si, en absence de
ligand chiral, un complexe de coordination possédant un centre métallique stéréogène (complexe chirométallique) est capable de transférer cette information chirale sur un substrat lors d’une réaction catalytique était une question fondamentale pour la chimie
[1]. Il est en effet connu que la proximité du centre chiral du centre réactionnel a une forte influence sur l’énantiosélectivité d’une réaction. Dans le cas des catalyseurs chirométalliques ou le centre catalytique est le centre stéréogène, ils ne peuvent être plus proches. De ce fait, une haute énantiosélectivité peut être espérée.
Un pré requis à cette recherche est la mise au point de préparations rapides et efficaces de complexes énantiomériquement purs avec le centre métallique comme seul élément de chiralité. Ceci en soi constitue un axe de recherche fondamental original
[2].
Nous avons démontré qu’un complexe de ruthénium énantiopur Δ ou Λ-[Ru(dmp)2(CH3CN)2]2+ était en mesure d’oxyder sélectivement des alkylarylsulfures par H2O2, sans production de sulfone et avec des excès énantiomériques n’excédant pas 18 %
[3]. Cependant, par cet exemple, nous avons montré qu’un tel complexe avait le double potentiel de réaliser une chimie centrée sur le métal et ceci de façon catalytique tout en transférant son information chirale sur le substrat. (Figure 1)
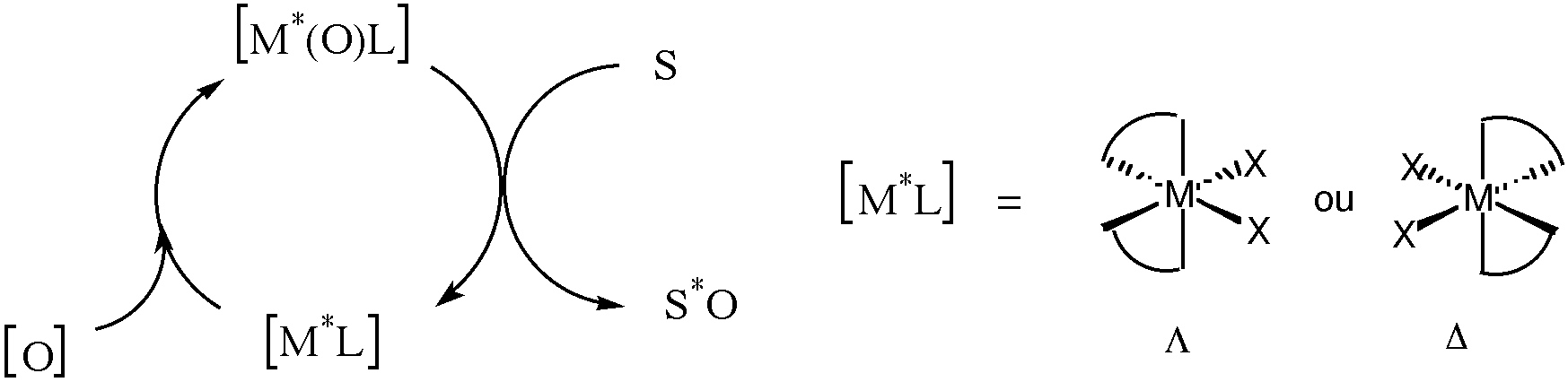
Figure 1 : Catalyse asymétrique par des complexes chirométalliques
Parallèlement, nous travaillons sur une évolution originale de ce travail consistant à utiliser ce type de complexe chiral-seulement-au-métal non plus en tant qu’une entité catalytique propre mais plutôt en tant que ligand chiral («métalloligand») d’un second centre métallique. De ce fait, ce catalyseur peut être impliqué dans des réactions catalytiques aussi diverses que nombreuses selon la nature du second métal utilisé. (Figure 2).
Ainsi, des complexes dinucléaires de ruthénium ne possédant aucun ligand organique chiral ont révélé une aptitude intéressante lors de l’hydrogénation catalytique de cétones. En effet, via vraisemblablement un processus d'auto-induction, des excès énantiomériques de l’ordre de 26 % et des rendements allant jusqu’à 96 % ont été obtenus
[4]. À notre connaissance, seule l’équipe de Gladysz avait déjà utilisé cette stratégie
[5].
Il est certain que ces catalyseurs chirométalliques développés actuellement par cette équipe ne sont pas encore en mesure de rivaliser avec les meilleurs catalyseurs “biologiques” connus à ce jour. Néanmoins, ces exemples ont permis de valider le concept de transfert de l’information chirale par un complexe chirométallique et ceci de façon catalytique. Le travail d’optimisation est en cours.
Une molécule est dite
chirale si elle constitue l’image miroir d’une autre molécule avec laquelle elle ne se superpose pas. De tels objets se présentent alors sous deux formes, qui sont l’image miroir l’une de l'autre, et ces paires d’images miroirs sont appelées des
énantiomères. Du fait de cette asymétrie au niveau moléculaire, les deux formes d'une molécule lévogyre et dextrogyre (L et D), un médicament par exemple, peuvent avoir des effets physiologiques différents voire antagonistes.
En chimie, un
mélange racémique est un mélange en proportions égales des énantiomères lévogyre et dextrogyre d'une molécule chirale.
Un
ligand chiral est un ligand spécialement adapté pour la synthèse asymétrique. Ce ligand est d’ordinaire un composé organique énantiomériquement pur (énantiopur) qui se combine avec un centre métallique par chélatation afin de former un catalyseur asymétrique. Ce catalyseur permet de réaliser une transformation donnée en transférant son information chirale sur le substrat. Le produit obtenu est alors chiral. Dans une réaction catalytique, un équivalent de catalyseur est capable de réaliser la transformation d’un grand nombre d’équivalents de substrat.
Le premier ligand de ce type, la diphosphine DiPAMP a été développée en 1968 par
William S. Knowles et par la suite utilisé dans la production industrielle de la L-DOPA. Le développement de la catalyse asymétrique pour la synthèse organique industrielle (pharmacologie, agronomique etc) est en plein essor.
Excès énantiomérique ee = (énantiomère 1 - énantiomère 2) / (énantiomère 1 + énantiomère 2) x 100