C. Gerez, S. Ollagnier de Choudens, M. Pelosse
La maturation des sites métalliques tels que les centres fer-soufre (Fe-S), canoniques ou complexes (contenant des hétéroatomes supplémentaires), reste un domaine très actif et compétitif de la chimie bioinorganique. Les systèmes de maturation de ces centres Fe-S sont structurellement et fonctionnellement complexes et de plus en plus de maladies
[Reference] dues à un déficit dans le processus d'assemblage des Fe-S, ont été mises en évidence, soulignant l'importance d'étudier ce processus à un niveau moléculaire.
L'équipe de BioCatalysis a été pionnière dans l'étude au niveau moléculaire de la biogenèse du Fe-S chez les procaryotes. Chez les bactéries, il existe deux systèmes d'assemblage des centres Fe-S, le système ISC et le système SUF qui est responsable de la biogenèse des Fe-S en conditions de stress. Depuis 2000, l'équipe Biocatalyse travaille intensivement sur le système SUF, composé de six protéines SufA-SufB-SufC-SufD-SufS-SufE, en collaboration avec des spectroscopistes et des microbiologistes. L'équipe travaille également sur le système ISC, composé de sept protéines (IscS-IscU-IscA-HscA-HscB-Fdx et CyaY). Actuellement, une attention particulière est portée sur (i) les aspects structuraux et fonctionnels des complexes SufBCD et SufBCDSE avec leurs cofacteurs (Fe-S et FADH
2) ; (ii) l'entrée du fer dans ces complexes pour former le centre Fe-S ; (iii) la caractérisation biochimique et biophysique de mutants ISC permettant de contourner la frataxine CyaY (une thérapie contre l'ataxie de Friedreich chez les eucaryotes); (iv) la caractérisation biochimique et biophysique des protéines de type-A (SufA, NfuA, IscA, ...sauvage et variants) et de certains systèmes de transfert d'électrons permettant une biosynthèse efficace de composés à haute valeur ajoutée dans la cellule (NAD, Biotine, bisabolène, antibiotiques...).
Une étude approfondie du système de biogenèse des centres Fe-S eucaryote est essentielle pour mieux appréhender les maladies liées aux déficits d'assemblage de ces Fe-S comme mentionné ci-dessus. Nous travaillons dans l’équipe sur la machinerie mitochondriale ISC des mammifères (Figure 1). Parmi les vingt protéines impliquées dans ce processus, nous nous concentrons sur (i) les protéines ISCA1/2 et leurs partenaires impliqués dans l'étape tardive du processus d’assemblage et (ii) sur la frataxine (FXN), impliquée dans l'étape initiale de la biogenèse des centres Fe-S et dont la déficience est à l'origine de l'ataxie de Friedreich (FRDA).
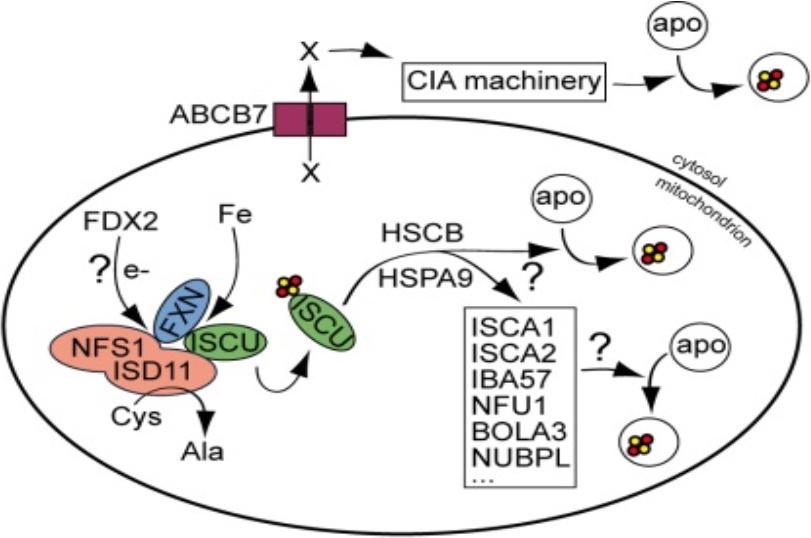
Figure 1 : Machinerie ISC mitochondriale.
e- : électron ; Fe : fer ; apo : apoprotéine ; X : inconnu ; CIA : machinerie Fe-S cytosolique ; cercles rouge et jaune : respectivement atomes de fer et de soufre.
 Collaborations sur le projet
Collaborations sur le projet :
F. Barras (Institut Pasteur, Paris) ; B. Py (LCB, Marseille) ; H. Puccio (INMG, Lyon) ; JM. Latour/ G. Blondin (PMB, LCBM, Grenoble) ; G. Veronesi (MCT, LCBM, Grenoble) ; J. Pérard (BEE, LCBM, Grenoble) ; G. Bokinsky (Delf, Hollande) ; J.C. Fontecilla-Camps (Métalloprotéines, IBS, Grenoble) ; S. Cianferani (IPHC, Strasbourg).
 Support financier
Support financier :
Agence nationale de la recherche (ANR FRACOL, ANR EraCoBioTech IronPlugNPlay)
 Sélection de publications
:
Py B, Gerez C, Huguenot A, Vidaud C, Fontecave M, de Choudens SO and Barras F
Sélection de publications
:
Py B, Gerez C, Huguenot A, Vidaud C, Fontecave M, de Choudens SO and Barras F
The ErpA/NfuA complex builds an oxidation-resistant Fe-S cluster delivery pathway.
Journal of Biological Chemistry, 2018,
293(20): 7689-7702
Pérard J and Ollagnier de Choudens S
Iron–sulfur clusters biogenesis by the SUF machinery: Close to the molecular mechanism understanding.
Journal of Biological Inorganic Chemistry, 2018,
23(4): 581-596
Correction.
Journal of Biological Inorganic Chemistry, 2018,
23(4): 597
Beilschmidt LK, Ollagnier de Choudens S, Fournier M, Sanakis I, Hograindleur MA, Clémancey M, Blondin G, Schmucker S, Eisenmann A, Weiss A, Koebel P, Messaddeq N, Puccio H and Martelli A ISCA1 is essential for mitochondrial Fe
4S
4 biogenesis
in vivo.
Nature Communications, 2017,
8: Article number 15124
Blanc B, Clémancey M, Latour JM, Fontecave M and Ollagnier de Choudens S Molecular investigation of Iron-Sulfur cluster assembly scaffolds under stress.
Biochemistry, 2014,
53(50): 7867-77869
Colin F, Martelli A, Clemancey M, Latour JM, Gambarelli S, Zeppieri L, Birck C, Page A, Puccio H and Ollagnier de Choudens S Mammalian frataxin controls sulfur production and iron entry during
de novo Fe
4S
4 cluster assembly.
Journal of the American Chemical Society, 2013,
135(2): 733-740
Tsaousis AD, Ollagnier de Choudens S, Gentekaki E, Long S, Gaston D, Stechmann A, Vinella D, Py B, Fontecave M, Barras F, Lukes J and Roger AJ Evolution of Fe/S cluster biogenesis in the anaerobic parasite
Blastocystis.
Proceedings of the National Academy of Sciences, 2012,
109(26): 10426-10431
Wollers S, Layer G, Garcia-Serres R, Signor L, Clemancey M, Latour JM, Fontecave M and Ollagnier de Choudens S Iron-sulfur (Fe-S) cluster assembly: The SufBCD complex is a new type of Fe-S scaffold with a flavin redox cofactor.
Journal of Biological Chemistry, 2010,
285(30): 23331-23341
Gupta V, Sendra M, Naik SG, Chahal HK, Huynh BH, Outten FW, Fontecave M and Ollagnier de Choudens S Native
Escherichia coli SufA, coexpressed with SufBCDSE, purifies as a [2Fe-2S] protein and acts as an Fe-S transporter to Fe-S target enzymes.
Journal of the American Chemical Society, 2009,
131(17): 6149-6153
Loiseau L, Gerez C, Bekker M, Ollagnier-de Choudens S, Py B, Sanakis Y, Teixeira de Mattos J, Fontecave M and Barras F ErpA, an iron sulfur (Fe S) protein of the A-type essential for respiratory metabolism in
Escherichia coli.
Proceedings of the National Academy of Sciences USA, 2007,
104(34): 13626-13631
Ranquet C, Ollagnier de Choudens S, Loiseau L, Barras F and Fontecave M Cobalt stress in
Escherichia coli: The effect on the iron-sulfur proteins.
Journal of Biological Chemistry, 2007,
282(42): 30442-30451
Layer G, Ollagnier-de Choudens S, Sanakis Y and Fontecave M
Iron-sulfur cluster biosynthesis: characterization of
Escherichia coli CYaY as an iron donor for the assembly of [2Fe-2S] clusters in the scaffold IscU.
Journal of Biological Chemistry, 2006,
281(24): 16256-63
Loiseau L, Ollagnier de Choudens S, Fontecave M and Barras F Analysis of the
Escherichia coli CsdA-CsdE heterodimeric cysteine desulfurase, a new [Fe-S] biogenesis system.
Journal of Biological Chemistry, 2005,
280: 26760-26769
Loiseau L, Ollagnier de Choudens S, Nachin L, Fontecave M and Barras F Biogenesis of Fe-S cluster by the bacterial Suf system: SufS and SufE form a new type of cysteine desulfurase.
Journal of Biological Chemistry, 2003,
278: 28352-28359
Ollagnier de Choudens S, Sanakis Y, Loiseau L, Nachin L, Barras F and Fontecave M SufA from
Erwinia chrysanthemi: Characterization of a scaffold protein required for iron-sulfur cluster assembly.
Journal of Biological Chemistry, 2003,
278: 17993-18001
Ollagnier de Choudens S, Mattioli T, Takahashi Y and Fontecave M Iron-sulfur cluster assembly: Characterization of IscA and evidence for a specific and functional complex with ferredoxin.
Journal of Biological Chemistry, 2001,
276: 22604-22607
 Livres
Puccio H and Ollagnier de Choudens S
Livres
Puccio H and Ollagnier de Choudens S Iron-sulfur cluster assembly in bacteria and eukarya using the ISC biosynthesis machinery Encyclopedia of Inorganic and Bioinorganic Chemistry, 2017 In ‘
Metalloprotein Active Site Assembly’, edited by Michael K. Johnson and Robert A. Scott. Chichester, UK: John Wiley & Sons, Ltd, pp. 1-19.
Barras F and Ollagnier de Choudens S Genetic, biochemical and biophysical methods for studying Fe-S proteins and their assembly Meth. Enzymol. 2017, Vol 595, Edited by Sheila S. David, pp. 1-32.