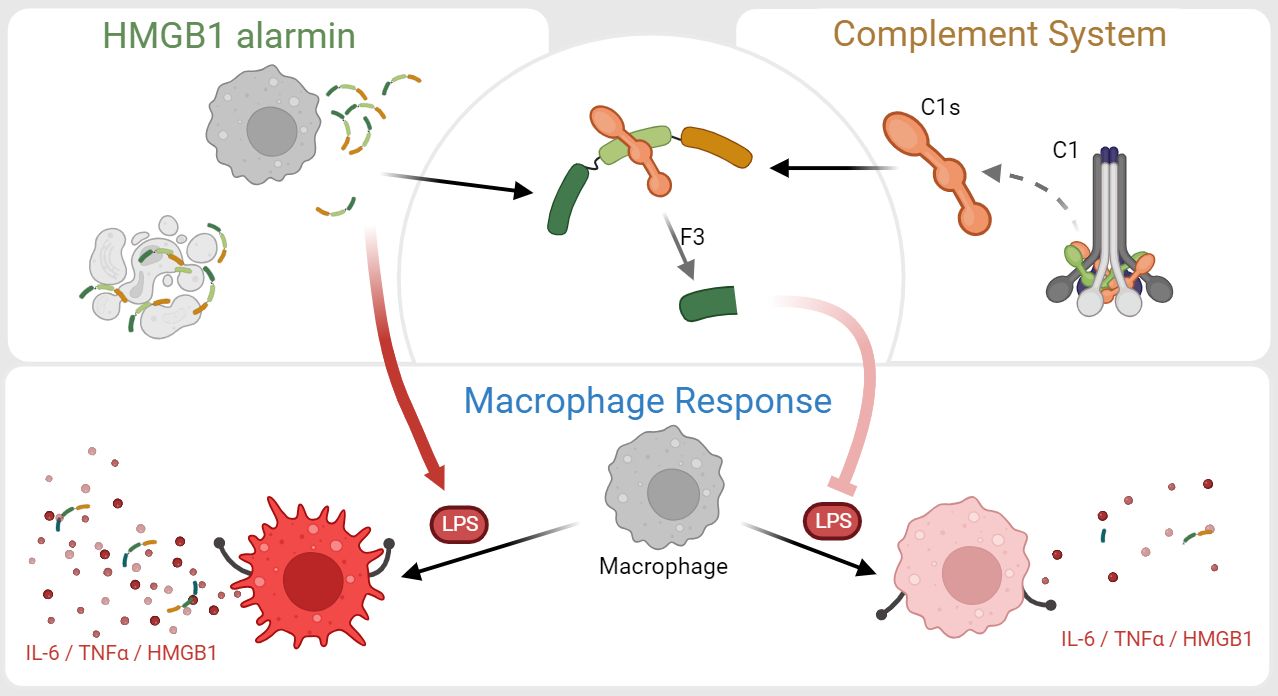
Les chercheurs de l’Irig, de l’équipe ProMIT de Thierry Rabilloud du LCBM, et de l’équipe de Christine Gaboriaud au sein du groupe CAID à l’IBS, conduisent des travaux sur la protéine HMGB1 normalement localisée dans le noyau des cellules. Cependant, elle est perçue comme un signal de danger dans l’environnement extracellulaire. De plus, une étude antérieure montre que lorsque cette protéine est coupée par la protéase C1s du système du complément, la fonction pro-inflammatoire de HMGB1 est significativement impactée dans le contexte de macrophage activés par les lipopolysaccharides (LPS). Afin d’élucider le mécanisme sous-jacent au niveau moléculaire, les chercheurs ont déterminé les sites de coupure précis de HMGB1 par C1s. L’impact fonctionnel des fragments N-terminaux libérés a ensuite été étudié en suivant la concentration de cytokines pro-inflammatoire (IL-6 et TNFα) dans le surnageant de macrophages activés par les LPS.
Leurs résultats ont révélé que le petit fragment N-terminal F3 (HMGB1 1-65), est capable de réduire significativement la quantité d’IL-6 sécrétée par les macrophages. Ce fragment F3 s’est également révélé être un meilleur inhibiteur que le fragments A-box de HMGB1, actuellement utilisé comme inhibiteur de la protéine entière dans la littérature.
Parallèlement à ses découvertes, ils ont également constaté que la coupure de HMGB1 est modulée par son état d’oxydo-réduction, dépendant du mode de relargage de la protéine : activement sécrétée par les cellules immunitaires ou passivement libérée après la mort cellulaire.
En résumé, cette étude montre comment les alarmines et le système du complément communiquent pour réguler l’activation du système immunitaire et met en évidence le potentiel de la protéase C1s dans la modulation de l’inflammation, donnant de précieuses indications pour les recherches futures.
Avec les soutiens financiers EUR de la thèse de Marie Lorvellec et du projet ANR DYSALARM