L’utilisation de procédés catalytiques a été développée par l’industrie chimique pour améliorer l’efficacité globale et donc la rentabilité des processus chimiques. La plupart des procédés développés mettent en jeu des catalyseurs métalliques à base de métaux lourds (ruthénium, rhodium, platine, etc..) dont la réactivité est plus nuancée et plus facile à maîtriser que celles des métaux de transition usuels (manganèse, fer, cobalt, etc..). Cependant, ces métaux lourds sont à la fois onéreux, de disponibilité limitée et toxiques pour l’homme et l’environnement. La prise en compte croissante des contraintes écologiques et de développement durable a donc amené depuis quelques années à leur chercher des substituts. Le métal qui s’impose
naturellement dans ce contexte est évidemment le fer
[1]. La chimie catalytique du fer avait été peu étudiée jusqu’à ces dernières années. Au contraire sa biochimie est connue de façon très détaillée, et en particulier les structures de nombreuses enzymes à fer ont été caractérisées par cristallographie et leurs mécanismes d’action ont été décrits en termes moléculaires
[2]. Ces enzymes catalysent de très nombreuses transformations chimiques dans des conditions très douces avec des efficacités et des sélectivités remarquables. Il résulte de ce constat qu’une
chimie biomimétique qui utilise les données issues de la biologie pour élaborer des catalyseurs chimiques à base de fer constitue une approche pertinente et prometteuse dans ce domaine.
C’est dans ce contexte que des chercheurs de notre laboratoire élaborent des modèles
[1] des sites binucléaires à fer des oxygénases pour en étudier les mécanismes d’action. La réalisation de
modèles biomimétiques de faible poids moléculaire permet de mettre en œuvre des études beaucoup plus précises que sur les enzymes elles-mêmes. Les oxygénases catalysent l’introduction d’un atome d’oxygène de l’oxygène moléculaire dans un substrat (Réaction 1) dans des conditions douces et avec une efficacité et une sélectivité qui ne sont pas encore atteintes dans les processus chimiques. Ceux-ci ont souvent recours à des donneurs d’oxygène (comme des peroxydes) pour obtenir de bonnes efficacités (Réaction 2). Cette équipe a montré récemment que les composés modèles des oxygénases peuvent catalyser une réaction similaire,
l’amination de substrats aliphatiques et aromatiques (Réaction 3)
[3], qu’aucune enzyme ne catalyse.
R-H + O2 + 2 e- + 2 H+ → R-OH + H2O
(1)
R-H + X=O → R-OH + X (2)
R-H + X=NR’ → R-NHR’ + X (3)
Cette réaction est intrinsèquement difficile à réaliser dans des conditions douces et les procédés classiques nécessitent plusieurs étapes coûteuses en temps et en énergie. Elle suscite un grand intérêt du fait de l’ubiquité des fonctions amines dans les produits d’intérêt biologique ou pharmaceutique.
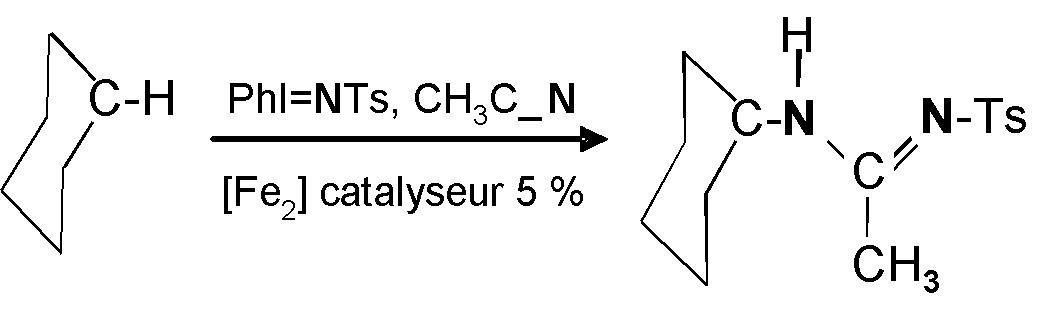
Figure 1 : Le cyclohexane (molécule de gauche) est un hydrocarbure très peu réactif, exemplaire des alcanes difficiles à oxyder. Son amination catalysée par les complexes du fer biomimétiques fournit une acétamidine (droite) dans des conditions douces. Ceci ouvre des perspectives intéressantes pour l’amination de nombreux substrats.
Les
composés modèles des oxygénases catalysent efficacement l’addition du groupe amine sur un cyclohexane qui est un substrat peu réactif (Figure 1). Ils permettent aussi d’introduire le groupe amine de façon intramoléculaire sur un groupe aromatique du complexe actif (Figure 2).
Au final, ces études ouvrent la voie à de nouvelles méthodologies de synthèse utilisant des catalyseurs originaux.
Dans les
composés modèles des sites actifs enzymatiques, les résidus protéiques qui lient le métal sont remplacés par un complexant synthétique possédant des atomes donneurs de même nature que la protéine et disposés de façon similaire. Ces composés permettent de réaliser des études mécanistiques très approfondies des réactions catalysées par les enzymes et de les décrire en termes moléculaires.
Biomimétique : qui reproduit une entité ou une réaction biologique.
L’amination est l’introduction d’une fonction amine (RR’NH) dans un cycle benzénique (amination aromatique) ou dans une chaîne carbonée (amination aliphatique).