La mise au point de nouveaux biocatalyseurs visant notamment des réactions de transfert d’oxygène représente un enjeu de premier plan dans le cadre du développement d’une chimie durable. Ce travail d’ingénierie sur la superoxyde réductase (SOR), de par la compréhension des mécanismes d’activation de l’oxygène qu’il permet, ouvre des perspectives intéressantes dans le domaine de la catalyse d’oxydation.
Les processus d’oxydation, dont la compréhension constitue toujours un défi majeur en biologie, sont essentiels dans les réactions de biosynthèse ou de biodégradation. Ils permettent l’incorporation d’atomes d’oxygène au niveau de liaisons chimiques particulièrement stables et peu réactives. En mutant différents résidus de l’environnement du fer de la SOR, une métallo-enzyme naturellement non impliquée dans des réactions d’oxydation, les chercheurs de l’équipe Biocatalyse du Laboratoire Chimie et Biologie des Métaux ont transformé cet enzyme en oxygénase. Ce travail a été inspiré par des analogies remarquables qui existent entre la SOR et les oxygénases à fer de type cytochrome P450 (cyt P450) (Figure).
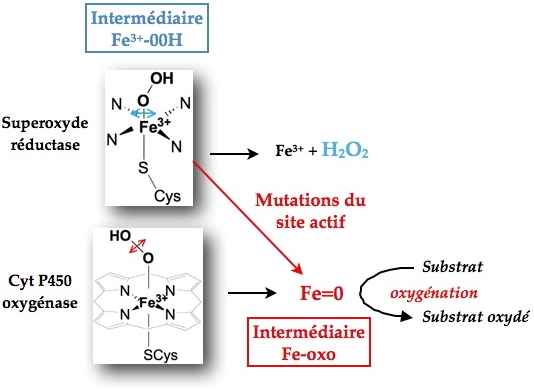
La SOR et le cyt P450 présentent une même coordination N4S1 au niveau du fer de leur site actif ainsi qu’un même type d’intermédiaire réactionnel Fe3+-OOH au cours de leur cycle catalytique. Cependant, cet intermédiaire évolue différemment dans ces deux systèmes. Pour la SOR, l’hydroperoxyde se détache du fer sous forme d’H2O2, alors que pour le cyt P450 il se clive au niveau de ses deux oxygènes pour former un fer-oxo à haut degrés d’oxydation, une espèce très oxydante qui permet l’oxygénation des substrats. Des mutations sur deux résidus de l’environnement du fer de la SOR ont permis de générer une espèce fer-oxo sur cet enzyme, caractérisée par spectroscopie de résonance Raman.
En combinant des approches de mutagenèse dirigée, de cinétique [1] et de spectroscopie de résonance Raman [2], cette équipe, en collaboration avec l’iBiTec-S, a montré que deux mutants de la SOR peuvent générer une espèce fer-oxo à haut degré d’oxydation, similaire à celle des oxygénases. Ces résultats ont permis de mettre en évidence la façon dont les systèmes enzymatiques contrôlent très spécifiquement la formation de ces espèces fer-oxo, tout en préservant l’environnement cellulaire de dommages oxydatifs non-spécifiques. Jusqu’à présent, ces données n’avaient pas pu être directement étudiées sur les oxygénases.
Ces travaux utilisant la superoxyde réductase ont permis de développer un modèle sans précédent pour l’étude des mécanismes d’activation de l’oxygène et de catalyse d’oxydation. Ces données pourront conduire à la conception de nouveaux biocatalyseurs utilisables en synthèse chimique.