Bien que ces enzymes soient très efficaces dans l'élimination du radical superoxyde, ils conduisent tous deux à la production de peroxyde d'hydrogène, un composé lui aussi toxique pour les cellules. Les activités SOD et SOR doivent donc être associées à des activités catalase et peroxydase pour permettre une détoxification complète.
Notre laboratoire, en collaboration avec une équipe d'Orsay et une équipe du CEA de Cadarache, vient de mettre en évidence une nouvelle activité de détoxication du radical superoxyde, permettant son élimination sans production de peroxyde d'hydrogène. Ce mécanisme de détoxication est le fait d'une utilisation sans précédant de ferrocyanure comme cofacteur par la superoxyde réductase SOR.
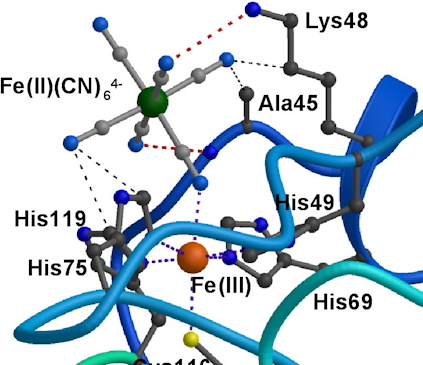
Complexe SOR-ferrocyanure.
Le ferrocyanure, véritable cofacteur de la SOR, est fixé au site actif par l'intermédiaire d'un pont cyano et de liaisons hydrogène entre les CN et plusieurs acides aminés de la seconde sphère de coodination du fer de la SOR.
Le site actif de la SOR, un centre mononucléaire de fer, présente la propriété singulière de complexer très spécifiquement une molécule de ferrocyanure Fe(CN)6. Nous avons montré que la présence de ferrocyanure associée à la SOR modifie de façon importante la réaction de l'enzyme avec le superoxyde. En présence du complexe, la réaction est alors centrée sur l'adduit ferrocyanure. Le superoxyde est toujours réduit à un électron, comme pour la SOR seule, mais le peroxyde d'hydrogène n'est plus le produit de cette réaction. À la place, il y a formation d'un alkylperoxyde, bien moins toxique pour la cellule.
Ces données obtenues in vitro sont totalement en accord avec celles obtenues in vivo. Elles montrent que lorsque le complexe SOR-ferrocyanure se forme dans la cellule, une augmentation importante de l'activité de protection de la SOR contre le stress superoxyde est observée.