Impliqués dans de nombreuses fonctions biologiques telles que les mécanismes de transcription, de traduction, de réplication de l’ADN ou de régulation de la quantité de fer cellulaire, les centres fer-soufre (Fe/S) sont des cofacteurs essentiels à la vie. La synthèse des Fe/S est assurée dans la mitochondrie par un complexe multi-protéique, une des machineries cellulaires les plus conservées au cours de l’évolution. Commune à l’ensemble du règne animal, elle est présente de la bactérie à l’homme où elle entraîne de nombreuses maladies telles que des ataxies, encéphalopathies, anémies, ou myopathies, lorsque elle est défaillante.
Initialement mise en cause dans l’ataxie de Friedreich où elle est déficiente, la fonction de la frataxine, une des quatre protéines qui compose le complexe multi-protéique responsable de la synthèse des Fe/S, suscite l’intérêt de la communauté scientifique. Cette pathologie rare concerne une naissance sur 50 000, et des stratégies thérapeutiques tentent de réduire les effets néfastes qui découlent de l’absence de frataxine fonctionnelle. Différents travaux ont montré son implication dans le métabolisme du fer cellulaire et plus récemment dans la synthèse des Fe/S.
Les études menées au laboratoirea en collaboration étroite avec le groupe de H. Puccio à l’IGBMC de Illkirch et des biophysiciens du CEA-Grenoble (chercheurs de notre laboratoire et de Inac/SCIB) ont permis de dévoiler le rôle de la frataxine au cours de l’étape initiale de la biosynthèse des Fe/S. Ces chercheurs ont comparé, par une approche interdisciplinaire alliant biologie moléculaire, biochimie et biophysique, l’activité du complexe protéique en présence et absence de frataxine. Ils ont mis en évidence le rôle de la protéine lors de l’assemblage des Fe/S, où elle contrôle l’arrivée du fer dans le complexe via l’activation de la cystéine désulfurase, une enzyme du complexe qui fournit les atomes de soufre à partir de L-cystéine (
Figure). Ils montrent ainsi pour la première fois que les Fe/S se forment par arrivée simultanée des deux éléments qui les constituent. De plus, ils mettent en évidence que la frataxine protège les Fe/S nouvellement formés dans le complexe au sein de la protéine échafaudage ISCU (
Figure) en empêchant la dissociation de l’édifice protéique pour permettre leur transfert aux protéines mitochondriales dont l’activité en dépend.
Une meilleure connaissance du fonctionnement de cette protéine au niveau moléculaire est primordiale pour la conception de traitements plus efficaces qui s’attaquent directement à la cause de ce trouble, en créant, par exemple, des molécules capables de mimer les propriétés biologiques de la frataxine.
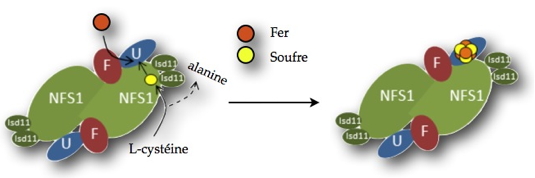
Rôle de la frataxine dans l’assemblage des centres fer-soufre.
F : frataxine. NFS1 : cystéine désulfurase. Isd11 : partenaire de NFS1. U : protéine échafaudage ISCU. En orange : atome de fer, en jaune : atome de soufre.
L'ataxie de Friedreich est une maladie neurologique, évolutive, rare et d'origine génétique. Ataxie signifie incoordination des mouvements, due à l'atteinte du cervelet et de la sensibilité profonde.