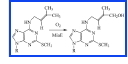
 La protéine MiaE de Salmonella tiphymurium est impliquée dans la dernière étape de biosynthèse de ms2io6A, un ARNt hypermodifié, en catalysant une hydroxylation très selective du substrat ms2i6A. L'enzyme a été exprimée de façon hétérologue chez Escherichia coli et les études biochimiques et spectroscopiques (UV-visible, RPE, Mössbauer et HYSCORE) ont permis de conclure que l'enzyme MiaE est une métalloenzyme à fer non héminique contenant un centre binucléaire de fer similaire à celui trouvé dans la méthane monooxygénase et absolument essentiel à l'activité enzymatique.
La protéine MiaE de Salmonella tiphymurium est impliquée dans la dernière étape de biosynthèse de ms2io6A, un ARNt hypermodifié, en catalysant une hydroxylation très selective du substrat ms2i6A. L'enzyme a été exprimée de façon hétérologue chez Escherichia coli et les études biochimiques et spectroscopiques (UV-visible, RPE, Mössbauer et HYSCORE) ont permis de conclure que l'enzyme MiaE est une métalloenzyme à fer non héminique contenant un centre binucléaire de fer similaire à celui trouvé dans la méthane monooxygénase et absolument essentiel à l'activité enzymatique.
Il s'agit de la première monooxygénase impliquée dans la modification post-transcriptionnelle des ARN de transfert.