Les centres fer-soufre (Fe-S) sont parmi les plus anciens groupes prosthétiques présents chez tous les organismes vivants. Les protéines qui les contiennent sont impliquées dans des processus cellulaires essentiels que sont la photosynthèse, la respiration, le transfert d’électrons… In vivo, la formation des centres fer-soufre n’est pas spontanée, mais résulte d’un processus de biosynthèse extrêmement contrôlé qui met en œuvre une machinerie protéique complexe identifiée aussi bien chez les procaryotes que chez les eucaryotes. La compréhension des mécanismes moléculaires permettant un assemblage correct des centres Fe-S est au cœur des préoccupations actuelles dans ce domaine de recherche. Ceci implique au préalable la caractérisation structurale et fonctionnelle des protéines d’intérêt qui le plus souvent s’effectue in vitro sur des systèmes purifiés. Parfois source de contradictions, il est nécessaire aujourd’hui de se tourner vers l’étude des protéines dans un contexte beaucoup plus physiologique.
Les centres fer-soufre (Fe-S) sont des cofacteurs d’enzymes qui existent sous différentes nucléarités, les centres [2Fe-2S] et [4Fe-4S] étant les plus communément rencontrés dans la cellule. Chez
Escherichia coli, la biosynthèse des centres fer-soufre implique deux machineries, organisées sous la forme d’opérons, la machinerie Isc (
iscRSUA-hscAB-fdx) et la machinerie Suf (
sufABCDSE), dont les mécanismes moléculaires conduisant à la formation d’un centre fer-soufre dans une protéine cible sont encore mal compris
[1]. Seules certaines étapes du mécanisme ont été bien étudiées : les cystéines désulfurases (IscS et SufSE) fournissent le soufre inorganique, parfois via une protéine relais (SufE)
[2, 3] à une protéine dite « échafaudage » (scaffold) (IscU et SufBC2D) dans laquelle un centre fer-soufre [2Fe-2S] ou [4Fe-4S] est assemblé transitoirement avant d’être transféré à des protéines cibles acceptrices de centres Fe-S. Le rôle des protéines dites de type-A (IscA et SufA) est beaucoup plus énigmatique. Certaines études
in vitro ont montré que IscA pouvait fixer du fer ferric (Fe
3+) et le transférer à IscU durant l’assemblage de son centre Fe-S
[4]. Un rôle similaire de donneur de fer pour SufA a été proposé.
A contrario, d’autres études montrent
in vitro qu’aussi bien IscA que SufA pouvaient assembler et transférer un centre fer-soufre ([2Fe-2S] et/ou [4Fe-4S]) à des protéines cibles
[5-7].
Protéines à fer ou protéines à fer-soufre?
Pour clarifier le rôle biologique des protéines de type-A, des chercheurs de notre laboratoire et de l’équipe de recherche de Wayne Outten (Department of Chemistry and Biochemistry, South Carolina University, Columbia, USA) ont co-exprimé les six gènes de l’opéron suf chez
E. coli et purifié la protéine SufA en anaérobiose. Sans aucun traitement chimique et par une analyse pluridisciplinaire mêlant la biochimie et la spectroscopie (Résonance Paramagnétique Electronique, Mössbauer, Raman de Résonance et Absorption UV-visible) ces chercheurs ont été en mesure de montrer sans ambiguïté que la totalité du fer contenu dans SufA après purification est sous forme d'un centre fer-soufre ; plus particulièrement que SufA est une protéine [2Fe-2S] (
Figure). SufA purifiée sous cette forme native est capable de transférer son centre fer-soufre à des protéines acceptrices de type [2Fe-2S] et [4Fe-4S]
[8].
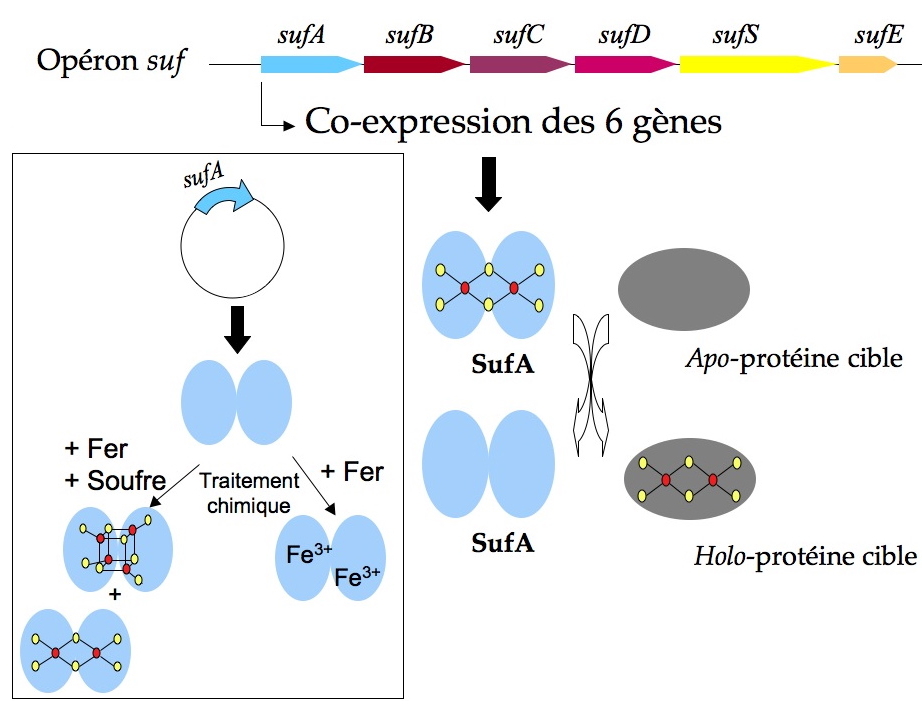
Lorsque SufA est co-exprimée avec l’ensemble de la machinerie Suf elle est purifiée directement avec son cofacteur métallique, un centre de type [2Fe-2S]. Ce centre est capable d’être transféré à des apo-protéines cibles. L’encadré montre la caractérisation de SufA en tant qu’entité isolée : SufA surexprimée seule est obtenue sous forme d’apo-protéine après purification. Suivant le traitement chimique in vitro subi ultérieurement (+ Fe ou + Fe et S) elle peut être caractérisée soit comme une protéine à fer soit comme une protéine à Fe-S (avec dans ce cas un mélange de [2Fe-2S] et [4Fe-4S]).
Ces résultats clarifient la fonction biologique de SufA en tant que protéine fer-soufre, plutôt que protéine à fer ; apportent une pièce supplémentaire d’importance au puzzle que constitue l’assemblage des centres fer-soufre et met en avant l’importance (d’actualité
[9]) d’étudier les métalloprotéines dans un contexte
in vivo plutôt qu’en tant qu’entité isolée.