L'accumulation dans les tissus de dépôts de protéines insolubles (fibres amyloïdes) en raison du mauvais repliement de protéines est associée à de nombreuses maladies humaines. Dans le cas de pathologies neurodégénératives comme les maladies d’Alzheimer et de Parkinson, l’observation de dépôts amyloïdes est corrélée à une apoptose anormale.
L'apoptose est un processus actif de mort cellulaire impliqué dans le développement des organismes. La régulation anormale des processus apoptotiques conduit à de nombreuses pathologies allant des maladies neurodégénératives et auto-immunes aux cancers. Les protéines de la famille Bcl-2 sont des transducteurs moléculaires sensibles aux signaux internes et externes apoptotiques. Par conséquent, ils jouent un rôle clé dans la régulation de l'apoptose.
Dans une récente étude, des chercheurs du laboratoire ont décrit la formation in vitro de différents types d'agrégats par Bcl-xL, une protéine anti-apoptotique de la famille Bcl-2. Selon les conditions physico-chimiques, cette protéine forme trois types d’agrégats : des micelles, des fibrilles dans lesquelles la protéine garde sa structure native, et des fibres amyloïdes. Les expériences de ces chercheurs suggèrent que les fibrilles sont formées par l'association de micelles. Les fibres amyloïdes sont stabilisées par des feuillets ß intermoléculaires ; ces structures non-natives sont formées aux dépens de la structure fonctionnelle de la protéine et il en résulte un mauvais repliement de cette dernière.
Dans une première tentative destinée à vérifier si la protéine Bcl-xL pouvait avoir un comportement similaire in vivo, cette équipe a suivi son comportement après l'avoir internalisée dans des neuroblastomes qui ont été ensuite soumis à un stress induisant la mort cellulaire. À la suite de ce stress, Bcl-xL est retrouvée localisée avec des dépôts amyloïdes suggérant que les modifications biochimiques qu'elle a subit conduisent à cette accumulation sous forme de protéines insolubles. En tant que membre de la famille Bcl-2, la protéine Bcl-xL est impliquée dans la régulation de l'apoptose. Les signaux apoptotiques mènent à des modifications post-traductionnelles des protéines Bcl-2 qui modifient leur comportement fonctionnel et peuvent conduire à la déstabilisation de leur structure native pour mener à la formation de dépôts amyloïdes.
Enfin, la formation de fibres amyloïdes par une protéine de la famille Bcl-2 suggère un lien entre les neuropathologies et les états physico-chimiques de ces protéines. En effet, si les protéines anti-apoptotiques, comme Bcl-xL, sont piégées dans des dépôts amyloïdes en raison de modifications post-traductionnelles induites par le stress, elles ne peuvent plus s'acquitter de leurs fonctions. Par conséquent, l'équilibre entre les protéines pro-et anti-apoptotiques qui régule l'apoptose est décalé vers la mort cellulaire. Ceci pourrait expliquer l’apoptose anormale observée dans les maladies neurodégénératives en lien avec l’apparition de dépôts amyloïdes (Figure).
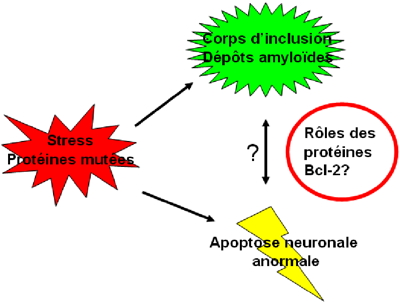
La mise en évidence de l’implication des protéines de la famille Bcl-2 dans les dépôts amyloïdes pourrait représenter un des verrous à la compréhension du développement des maladies neurodégénératives.
Modification post-traductionnelle : modification d'une protéine après sa synthèse par l’ajout d’un groupement chimique ou d’une petite protéine, réalisée le plus souvent par une enzyme et pouvant être réversible.