Depuis la découverte de la pénicilline en 1928, l’homme a largement développé et utilisé les antibiotiques pour lutter contre les infections microbiennes. Cependant, un emploi inadapté et une utilisation excessive de ces molécules a conduit à l’apparition de pathogènes résistants à de nombreuses voire toutes les classes d’antibiotiques. Selon l’Organisation Mondiale de la Santé, le monde se dirige vers une ère où des infections communes tueront de nouveau. L’OMS prédit que les pathogènes multi-résistants provoqueront la mort de 10 millions de personnes par an à l’horizon 2050, dépassant ainsi le nombre de décès lié au cancer. Développer des stratégies innovantes et trouver de nouvelles molécules efficaces est donc une urgence.
Des chercheurs de l’Institut des Sciences Moléculaires de Marseille et de notre laboratoire s’intéressent à
Ruminococcus gnavus, une bactérie qui vit en symbiose dans notre système digestif, pour sa capacité à produire des molécules antimicrobiennes telles que la ruminococcine C1 (RumC1). Les scientifiques sont parvenus à reproduire ce peptide d’origine naturelle en laboratoire pour étudier sa structure et son potentiel thérapeutique.
La structure tridimensionnelle de RumC1, résolue par RMN en collaboration avec l’Institut de Microbiologie de la Méditerranée, révèle un motif original très compact en double épingle, non décrit jusqu’ici. Cette structure confère à RumC1 des caractéristiques très intéressantes, qui font souvent défaut aux peptides antimicrobiens pour être considérés en développement clinique, notamment une grande résistance aux conditions physiologiques et à différents traitements physico-chimiques. Ces points s’avèrent cruciaux pour envisager une production de RumC1 à grande échelle et exploiter tout son potentiel thérapeutique.
RumC1 possède des propriétés essentielles pour un candidat-médicament destiné à traiter des infections intestinales, notamment parce qu’il est efficace à très faibles doses contre des pathogènes cliniques de l'intestin résistants aux antibiotiques et qu’il est actif dans des conditions mimant l’environnement intestinal. De plus, RumC1 n’a pas montré de toxicité envers les tissus cellulaires intestinaux et il pourrait être administré par voie orale.
Les chercheurs continuent actuellement leurs travaux afin d’élucider le mécanisme d’action et d’identifier la cible cellulaire de cette molécule originale dans la lutte contre l’antibiorésistance.
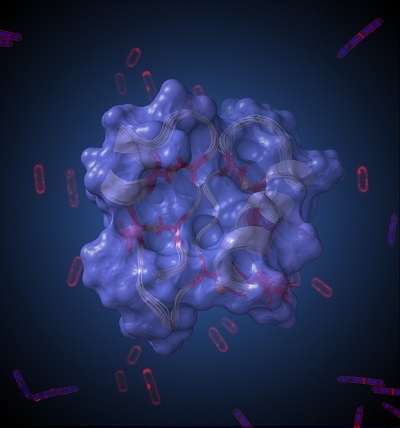
Représentation artistique de la structure 3D du peptide antimicrobien RumC1 résolue par résonance magnétique nucléaire.
Cette structure compacte en double épingle confère à RumC1 d’importantes propriétés cliniques, dont une remarquable activité bactéricide contre des pathogènes multirésistants aux antibiotiques courants.
© Clarisse Roblin et Matthieu Nouailler