Publié le 25 janvier 2019
Corps de texte 1
 Présentation
Présentation
Les oxygénases sont les enzymes capables d'insérer un atome d'oxygène dans un substrat à partir de l'oxygène moléculaire. Parmi celles-ci, la méthane monooxygénase, enzyme non hémique à site actif dinucléaire qui oxyde le méthane en méthanol, est la plus fascinante. D'autres enzymes de structures similaires ont des activités comparables, telle la toluène-2-monooxygénase qui oxygène le toluène en 2-crésol. La chimie de ces enzymes prend un relief particulier dans le contexte de l'élimination de polluants organiques. Ces enzymes activent l'oxygène moléculaire mais elles sont susceptibles de réagir également avec le peroxyde d'hydrogène et les hydroperoxydes formés au cours de réactions du stress oxydant.
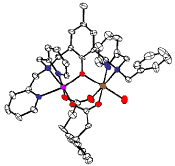
Structure cristallographique du cation complexe à valence mixte [FeIII(L-Bn)(mpdp)FeII(OH2)]2+
(FeIII : violet, FeII : marron) |
Le complexe [FeIII(L-Bn)(mpdp)FeII(NCCH3)](ClO4)2 (L-Bn = ligand binucléant porteur d’un groupe benzyle, mpdp = m-phénylènedipropionate) représenté sur la figure ci-contre est un modèle structural de l’hèmerythrine, le transporteur d’oxygène parent de la classe des protéines non hémiques à site actif dinucléaire. Nous avons montré en combinant des études électrochimiques et des études spectroscopiques UV-visible, RMN et surtout Mössbauer que la molécule d’eau coordonnée au fer(II) est remplacée en solution par l’acétonitrile et se déprotonne lorsque le complexe est oxydé à l’état FeIIIFeIII (Schéma 1). |
Schéma 1 : Le dicarboxylate mpdp est omis pour simplifier l’écriture :
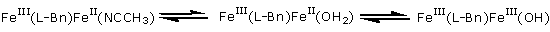
Lorsque ce complexe (ou son analogue avec le ligand L-tBu porteur d’un groupe tertiobutyle) est soumis à l’action de l’acide meta-chloroperbenzoïque (mCPBA), d’un iodosylarène (ArIO) ou du peroxyde d’hydrogène, l’oxygénation stoechiométrique du résidu aromatique ou aliphatique de la branche est observée (Schéma 2 et Figure ci-contre). |
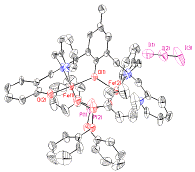
Structure cristallographique du cation complexe à valence mixte [FeIII(L-BnO)(dpp)FeII(OH2)]2+
(dpp = diphénylphosphate) |
Schéma 2 : Le dicarboxylate mpdp est omis pour simplifier l’écriture :
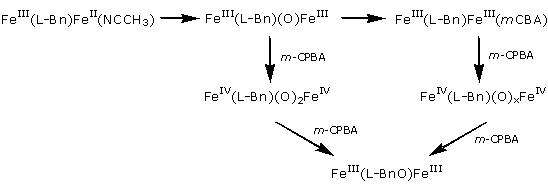 Les mécanismes de formation ont été étudiés par ESI-MS à l’aide de réactifs marqués (H218O, H218O2, 18O2) et se révèlent très différents selon le donneur d’oxygène et la nature du résidu hydroxylé. Ces mécanismes sont de deux types généraux. La réaction avec mCPBA passe par des intermédiaires (oxo)-bis-FeIII et (oxo)-bis-FeIV, alors qu’avec le peroxyde d’hydrogène des intermédiaires (hydroperoxo)-bis-FeIII et (oxo)- FeIIIFeIV sont formés.
Les mécanismes de formation ont été étudiés par ESI-MS à l’aide de réactifs marqués (H218O, H218O2, 18O2) et se révèlent très différents selon le donneur d’oxygène et la nature du résidu hydroxylé. Ces mécanismes sont de deux types généraux. La réaction avec mCPBA passe par des intermédiaires (oxo)-bis-FeIII et (oxo)-bis-FeIV, alors qu’avec le peroxyde d’hydrogène des intermédiaires (hydroperoxo)-bis-FeIII et (oxo)- FeIIIFeIV sont formés.
Schéma 3 : Le dicarboxylate mpdp est omis pour simplifier l’écriture :
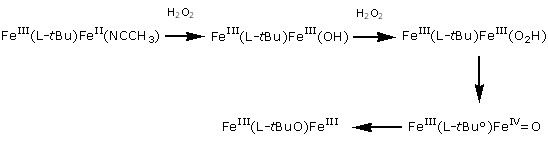
Haut de page