La connaissance des mécanismes catalytiques des enzymes antioxydants représente à la fois un enjeu majeur en biologique fondamentale mais aussi des perspectives importantes d’application dans le domaine de la santé humaine. Cela concerne notamment le développement de molécules de synthèse pouvant mimer l’activité de ces enzymes antioxydants dans le but de traiter les affections résultantes des effets toxiques de l’oxygène.
Bien que indispensable pour notre vie sur terre, l’oxygène n’en demeure pas moins un puissant toxique pour nos cellules. Heureusement, nous sommes dotés de systèmes enzymatiques très efficaces qui nous prémunissent contre cette toxicité en éliminant ses dérivés très réactifs qui se forment inévitablement au cours des métabolismes aérobies. Il s’agit notamment de la superoxyde dismutases (SOD) qui élimine les radicaux superoxyde. On sait à présent que lorsque ces activités antioxydantes sont insuffisantes par rapport à la formation des ces dérivés toxiques de l’O2, l’intégrité des cellules est fortement compromise, et dans certaines conditions cela peut conduire au développement d’affections graves, tels les cancers et maladies de dégénérescence cellulaire.
Durant ces dernières décennies, beaucoup d’efforts ont été réalisé pour développer des molécules de synthèse pouvant mimer l’activité de ces enzymes antioxydants, en particulier la superoxyde dismutase (SOD). Cependant ces approches se sont révélées peu productives et il est actuellement difficile de reproduire au niveau d’une molécule de synthèse une activité SOD efficace, dont le centre métallique joue à la fois un rôle d’oxydant et de réducteur vis-à-vis du super-oxyde.
En 2000, les chercheurs de notre laboratoire ont découvert que certaines bactéries n’éliminent pas le radical superoxyde par dismutation à l’aide des classiques SOD, mais par une réaction beaucoup plus simple impliquant une seule réduction du superoxyde. L’enzyme responsable de cette activité a été appelé superoxyde réductase SOR [1]. Il s’agit d’une petite métalloenzyme dont le site actif consiste en un atome de fer lié à la chaîne polypeptidique par l’intermédiaire de quatre azotes d’histidine et un soufre de cystéine, sans aucune similitude structurale avec celui des SOD [1] (Figure 1).
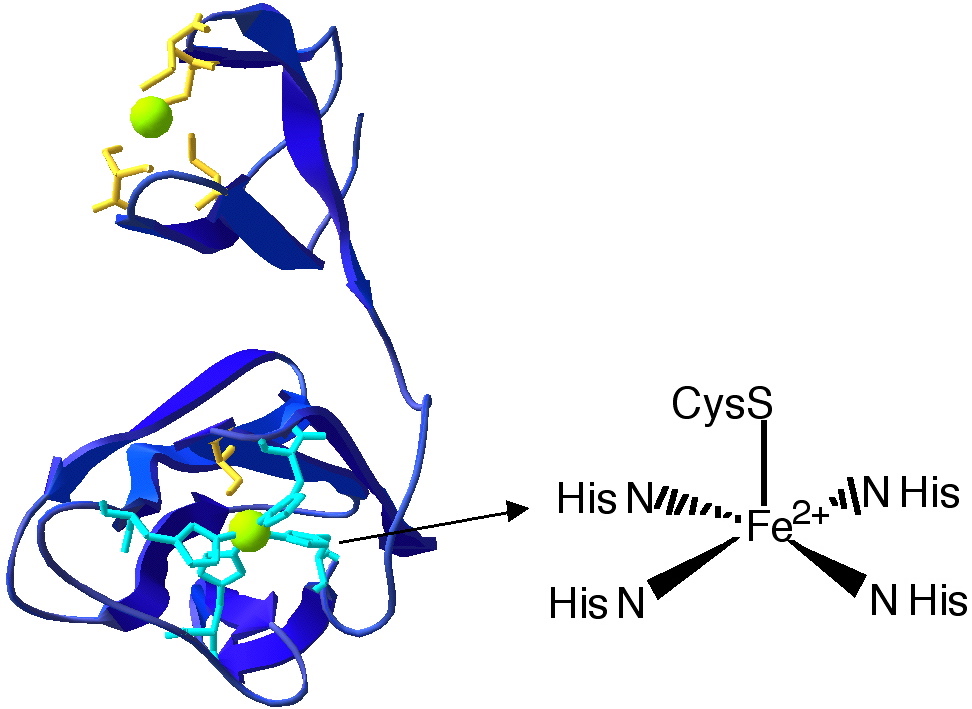
Figure 1 : Site actif de la SOR [Fe2+ HisN4 CysS1 ]
La connaissance du mécanisme par lequel ce nouveau système élimine le radical superoxyde peut s’avérer très utile pour le développement de nouvelles molécules antioxydantes comme alternatives à celles mimant la SOD. Il est donc important de comprendre par quels moyens le site actif de la SOR catalyse cette réaction de réduction. C’est sur ce point que les chercheurs de l’équipe Biocatalyse travaillent depuis plusieurs années, avec des résultats majeurs dans ce domaine [1-4].
Pour comprendre un mécanisme enzymatique, il est essentiel de caractériser le ou les intermédiaires réactionnels qui se forment au cours du cycle catalytique. Cela permet de déterminer la chimie particulière qui est réalisée au niveau du site actif de l’enzyme. Cependant, ce travail représente un vrai défi expérimental car ces espèces ont une durée de vie très courte et sont donc difficiles à étudier. En effet, si les techniques de cinétique rapide sont bien adaptées pour déterminer les vitesses de formation et de disparition de ces intermédiaires, elles sont en général peu performantes pour directement identifier leur nature chimique.
L’approche développée par ces chercheurs a été d’augmenter la durée de vie de l’intermédiaire réactionnel qui se forme au niveau du site actif de la SOR afin d’en faciliter son étude. Cela a été possible en modifiant par ingénierie des protéines certains résidus d’acide aminé du site actif. Ainsi, la durée de vie de l’intermédiaire est passée de quelques milli-secondes pour la SOR sauvage à plusieurs dizaines de seconde pour la SOR muté. Cette approche a été suffisante pour permettre son piégeage par congélation dans l’azote liquide une dizaine secondes après le déclenchement de la réaction.
L’intermédiaire congelé a pu être directement étudié par différentes spectroscopies, comme la résonance Raman, qui est une technique très performante pour caractériser la nature des liaisons chimique autour d’un centre métallique. Les mutants ont aussi été cristallisés et de la même manière qu’en solution, l’intermédiaire a pu être piégé au sein du cristal. Une structure a été déterminée à haute résolution par diffraction des RX par l’équipe de Dominique Bourgeois à l’IBS [4] (Figure 2). L’ensemble de ces données a montré que l’intermédiaire réactionnel est une espèce de type Fer-peroxyde, Fe-O-O(H), résultant de la fixation du radical superoxyde sur le site à fer de la SOR [2-4]. Ces résultats constituent une avancée très importante dans le domaine de la bio-inorganique, en particulier car les structures de ces espèces Fer-peroxyde sont très peu documentées.
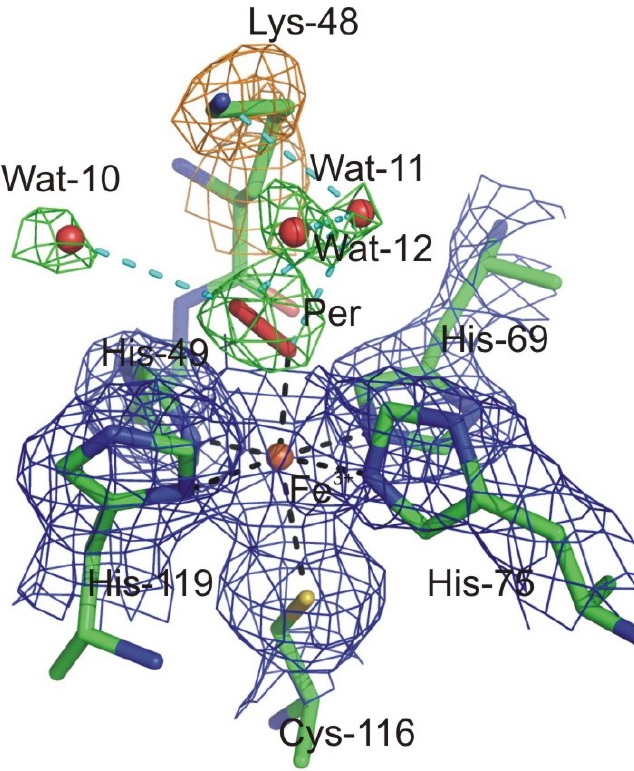
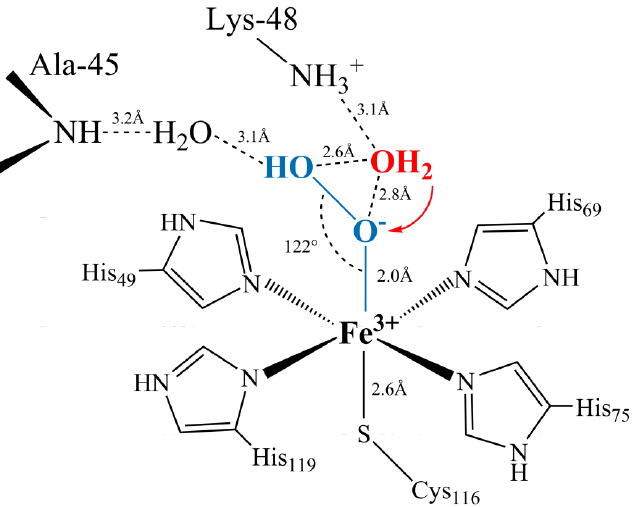
Figure 2 : Structure cristalline à 1,95 Å de résolution de l’intermédiaire Fer-peroxyde piégé au sein du site actif de la SOR. L’alanine 45 et la lysine 48 permettent l’établissement d’un réseau de liaisons hydrogène spécifique autour du peroxyde, impliquant plusieurs molécules d’eau.
Les chercheurs ont mis en évidence que l’intermédiaire Fer-peroxyde de la SOR présente des propriétés assez différentes de ce que l’on peut attendre d’une telle espèce. En effet, ces Fer-peroxydes sont en général décrits comme étant des espèces très oxydantes et donc très réactives. Il a été montré que le site actif de la SOR contrôle très fortement la réactivité du Fer-peroxyde tout en favorisant l’élimination très rapide du radical superoxyde. Cela est du à la présence du ligand cystéine du fer et d’un faisceau de liaisons hydrogène très spécifique autour de ce peroxyde. On comprend ainsi pourquoi la SOR peut utiliser un tel intermédiaire réactionnel pour une réaction de détoxification.
L’élaboration de modèles synthétiques de SOR devra tenir compte de ces propriétés mises en évidence sur l’enzyme en vue de permettre une élimination aussi spécifique qu’efficace du radical superoxyde. Il apparaît cependant que la présence d’un ligand soufré (équivalent de la cystéine) sur un complexe métallique mimant le site actif de la SOR est sans doute plus facile à reproduire au niveau d’une molécule de synthèse que le faisceau de liaison hydrogène caractérisé pour l’enzyme. Cependant, ce dernier n’en demeure pas moins un aspect très important à introduire d’une façon ou d’une autre au niveau d’un mimique de SOR afin d’en optimiser l’activité.