Afin d'améliorer la production d'huile par les microalgues pour des applications telles que le développement de biocarburants, le choix de l’espèce est crucial. Alors que certaines microalgues sont bien connues et permettent de cibler des gènes, l’étude d’autres microalgues débute par une page blanche. C’est le cas du groupe des Hétérokontes, une branche méconnue de l’évolution dans laquelle on compte des microalgues oléagineuses très intéressantes car cultivables de façon industrielle, telle que
Microchloropsis gaditana. C’est cette microalgue qui a été retenue par des chercheurs et ingénieurs de l’Irig dans le cadre d'un partenariat avec TotalEnergies, partenariat initié en 2014.
Lorsque le choix de l’espèce de microalgue est fait, l’approche rationnelle destinée à augmenter la production d’huile nécessite de viser des cibles génétiques sur lesquelles intervenir, en augmentant ou diminuant leur expression et/ou leur fonction. Quant à l'huile que l'on cherche à produire, elle correspond à une molécule de triacylglycérol (TAG), très hydrophobe. À l’intérieur de la cellule, le TAG est séquestré dans une structure sphérique qu’on nomme « gouttelette d’huile » ; il est en équilibre avec les autres glycérolipides cellulaires, tels que ceux trouvés dans les membranes biologiques qui ne contiennent que deux acides gras.
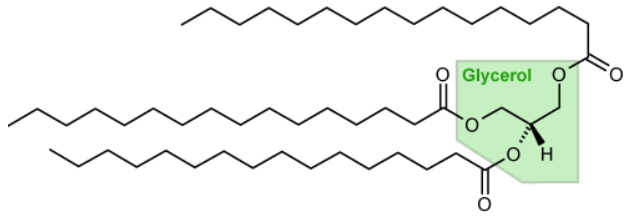
Une molécule de triacylglycérol (TAG) est constituée d’un squelette glycérol sur lequel sont estérifiés trois acides gras. Exemple du tripalmitoylglycérol. La formule générale des TGA est :
CH
2-COO-R1
|
CH-COO-R2
|
CH
2-COO-R3
En étudiant
M. gaditana, les chercheurs ont noté qu’il existait un enzyme nommé «
ACS Bubblegum », de type
Acyl-CoA Synthétase (ACS), d’un type jamais décrit chez les organismes photosynthétiques. Par édition génomique à l’aide de ciseaux moléculaires (méthode CRISPR-Cas9), il n’a pas été possible d’abolir complètement ce gène chez
M. gaditana, soulignant son rôle vital. Toutefois plusieurs modifications très fines du gène codant ACSBG ont altéré sa fonction. Chez ces mutants, une étude de tous les glycérolipides membranaires et du TAG a été réalisée sur la plate-forme lipidomique LIPANG du laboratoire. Cette étude a permis de caractériser le rôle précis d’ACSBG. Cet enzyme prépare des acides gras pour leur estérification sur certains lipides membranaires. Les mutations introduites dans le gène provoquent des modifications structurales qui influent directement sur son activité (
Figure). Ces perturbations de la synthèse de lipides membranaires sont alors compensées par une réorientation des acides gras, qui se retrouvent en excès, vers les TAG, d’où un gain de productivité en huile.
L'ACS nommé « ACS Bubblegum » (ou ACSBG), tient son nom de l’effet de la mutation correspondante chez la mouche drosophile, caractérisé par l’apparition de structures en forme de bulles dans le premier ganglion optique, ainsi que par un déséquilibre lipidique fort.
Il est possible d’agir sur les enzymes qui dirigent les acides gras vers les lipides membranaires ou les TAG. Les acides gras ne peuvent pas être estérifiés directement car la réaction d’estérification requiert de l’énergie. Ils doivent être préalablement couplés à un groupement chimique, par exemple le Co-enzyme A (CoA), au travers d’une liaison qui « stocke » l’énergie nécessaire à une estérification ultérieure. Les acides gras sont ainsi « préparés », ou activés énergétiquement, par association au CoA par des enzymes appelées Acyl-CoA Synthétases (ACS).
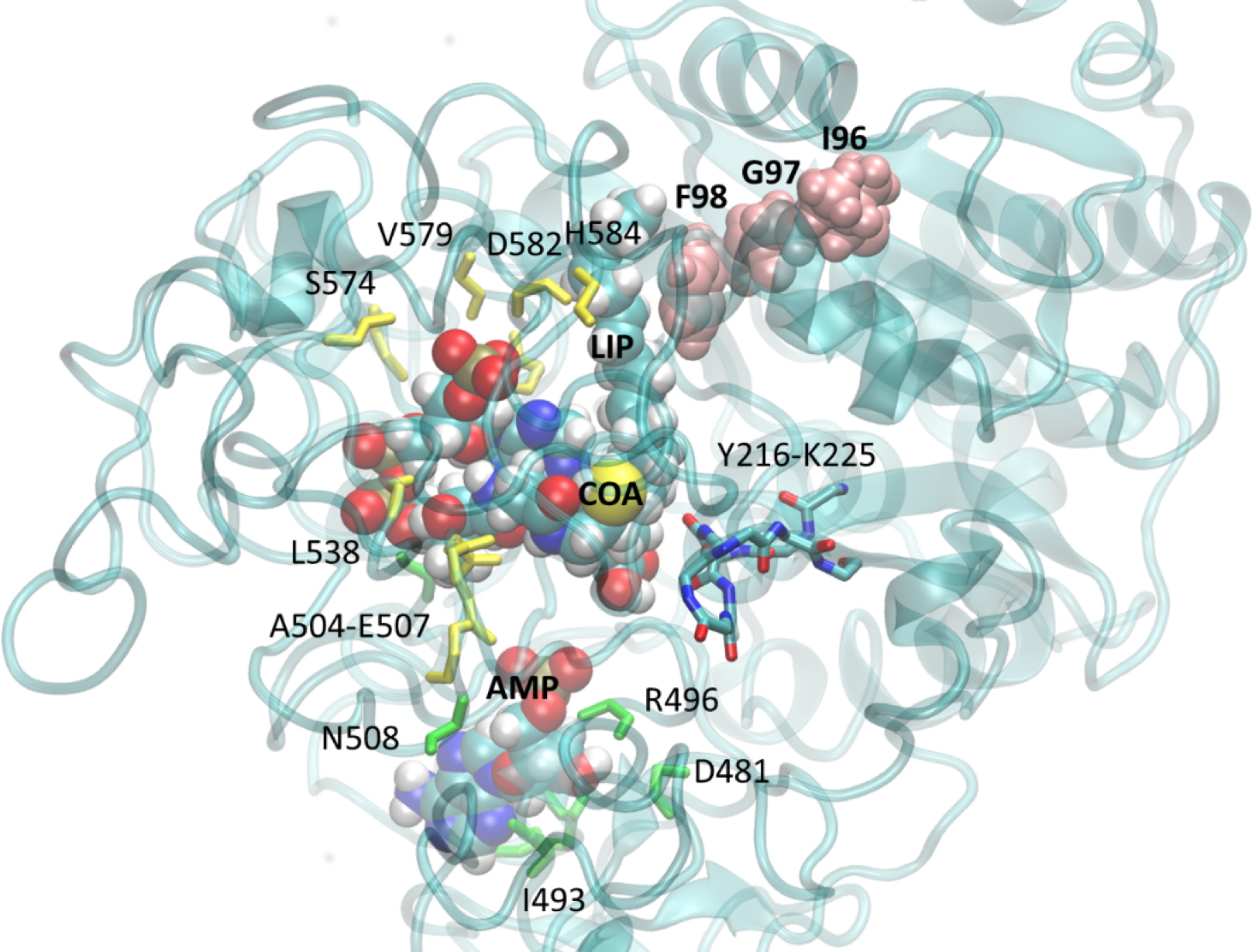 Modèle 3D de la protéine ACSBG de M. gaditana, associée à ses substrats, le coenzyme-A (CoA), l’Adénosine Monophosphate (AMP) et un acide gras (LIP). Les mutations ponctuelles introduites par édition génétique à l’aide de CRISPR-Cas9 se trouvent au niveau des acides aminés « IGF » (en rose). Ces mutations modifient la conformation de la protéine au niveau du site catalytique (repéré par les acides aminés numérotés), et provoquent une baisse de l’activité enzymatique conduisant à une réorientation complète des flux d’acides gras dans la cellule.
Modèle 3D de la protéine ACSBG de M. gaditana, associée à ses substrats, le coenzyme-A (CoA), l’Adénosine Monophosphate (AMP) et un acide gras (LIP). Les mutations ponctuelles introduites par édition génétique à l’aide de CRISPR-Cas9 se trouvent au niveau des acides aminés « IGF » (en rose). Ces mutations modifient la conformation de la protéine au niveau du site catalytique (repéré par les acides aminés numérotés), et provoquent une baisse de l’activité enzymatique conduisant à une réorientation complète des flux d’acides gras dans la cellule.
Ces travaux ont été menés en collaboration entre les équipes Lipid, Photosynthesis, Signal et Flo_RE du LPCV et TotalEnergies. Serge Crouzy du laboratoire Chimie et Biologie des Métaux de l’Irig a quant à lui réalisé les modélisations structurales de l’enzyme. Ces travaux ont fait l’objet d’un brevet.