Dans le cadre de la biologie de synthèse, la biocatalyse représente la solution la plus prometteuse pour développer une chimie durable. Pourtant, il reste notamment à développer les réactions abiotiques et une meilleure stabilité des biocatalyseurs. L'approche que nous développons consiste en la mise au point de métalloenzymes artificielles (ArMs) : des complexes inorganiques bio-inspirés sont introduits au sein de cavités hydrophobes de protéines. Le complexe inorganique joue le rôle du centre réactif (artificiel) alors que la protéine apporte stabilité et (énantio)sélectivité. L'objectif de notre projet est de mettre au point des catalyseurs hybrides actifs dans le cadre d'oxydations en privilégiant les réactions de transfert d'oxygène asymétrique sur une quantité non limitée de substrat.
 Catalyseurs chiraux hybrides protéiques : vers des métalloenzymes artificielles hétérogènes et multifonctionnelles
Catalyseurs chiraux hybrides protéiques : vers des métalloenzymes artificielles hétérogènes et multifonctionnelles
En collaboration avec les équipes BEE et COMMIX de notre laboratoire.
Malgré tous les progrès faits en recherches, il est difficile, aujourd'hui encore, de prévoir le résultat d'une catalyse chimique énantiosélective. Par contre, le contrôle de ces réactions est parfaitement maitrisé par des métalloenzymes, par la nature de la structure de la première ainsi que la deuxième sphère de coordination du métal au sein de la protéine. Notre approche vise à s’inspirer de ce mode de contrôle pour assurer des réactions d’oxydations énantiosélectives par la mise au point d’enzymes artificielles. Le choix de l’enzyme est NikA, un transporteur de Ni chez E. coli et les complexes inorganiques insérés dans la protéine jouant le rôle de site actif sont issus de la catalyse inorganique pour les transferts d’oxygène ou d’azote et de la fixation de CO2. Trois types de catalyses sont alors envisagées puis comparées ; le plus souvent pour les transformations d’alcènes.
Catalyse
in vitro : Des enzymes artificielles NikA@ML (avec M = Fe, Ru, Mn) permettent des réactions d’hydrochloration et d’époxydation dans un tampon alors que les complexes seuls sont totalement inactifs. Ce phénomène est toujours observé ce qui démontre de l’importance de la structure de la protéine.
Devant nos faibles réussites sur l’énantiosélectivité nous avons décidé d’utiliser l’IA pour créer "from scratch" des enzymes artificielles efficaces pour la catalyse de sulfoxydation en prenant l’ésoméprazole réduit comme substrat. La méthodologie est aujourd’hui maitrisée et les résultats devraient suivre.
D’autres biomolécules sont en cours de tests comme les G-quadruplexes qui ont été utilisés pour des réactions de sulfoxydation.
Catalyse
in vivo
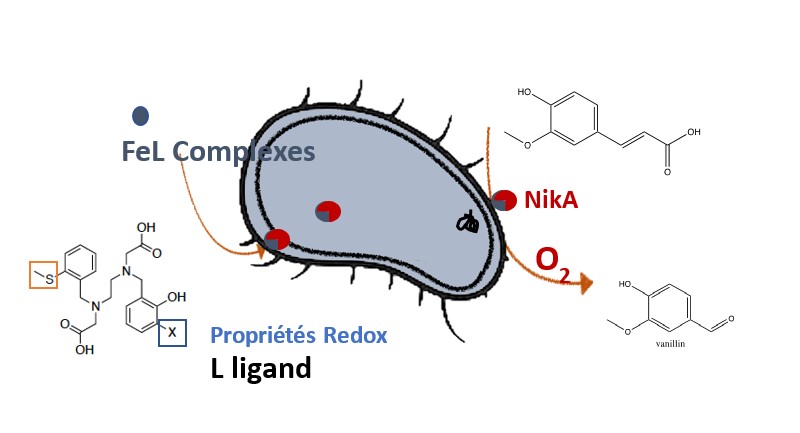
: Nous cherchons à produire notre enzyme artificielle directement chez
E. coli par l’ajout de notre complexe dans des cultures de bactéries. Ici, la plus-value réside dans la production continue d’enzyme artificielles permettant une production importante de produits d’intérêts et donc une stabilité virtuelle plus importante. Ce travail est illustré par la production de vanilline à partir de résidus de la lignine comme l’acide férulique.
Catalyse
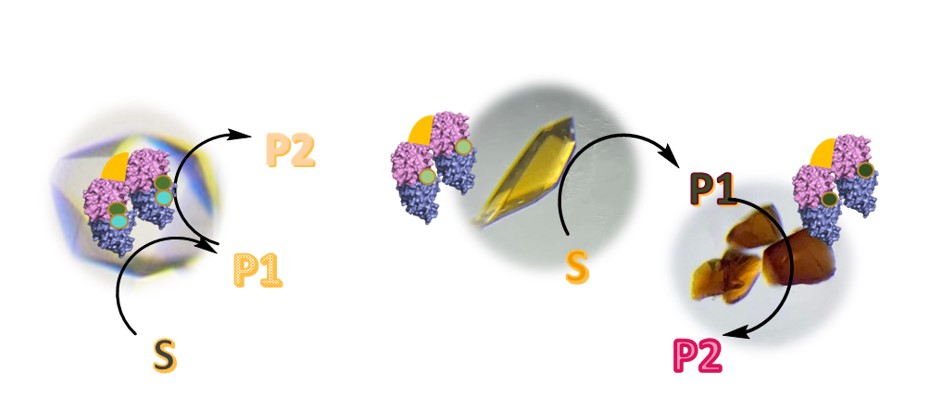
in cristallo : Il s’agit ici de transposer l’hétérogénéisation dans le domaine de la biocatalyse par l’utilisation de cristaux de protéines catalytiques. Nous avons mis au point des catalyseurs hybrides hétérogènes grâce à une stabilisation des cristaux protéiques par la technique CLEC (Cross Linked Enzyme Crystals). Dans ces CLEC, sont internalisés, au choix, des complexes inorganiques en fonction de la réaction visée. Ces catalyseurs hétérogènes sont très stables vis-à-vis des conditions oxydantes, solvants organiques, agitation, température, pH. Ils nous ont permis de réaliser, par exemple, une réaction de coupure oxydante d’alcènes en utilisant le dioxygène de
l’air avec un TON supérieur à 30 000.
Aujourd‘hui nous projetons d’appliquer ces concepts à d’autres réactions comme le transfert d’azote. D’autre part, nous tentons de développer des réactions cascades à l’aide des CLEC en insérant non pas un mais deux sites actifs artificiels, dans le but d’éviter des interférences entre les catalyseurs et gagner en sélectivité. La formation de carbonates cycliques inorganiques à partir d’un alcène est obtenue par l’insertion dans un même cristal de protéine NikA de deux complexes (Co et Mn) insérés par deux méthodes différentes : une stabilisation du complexe par liaison supramoléculaire comme toujours et par liaison covalente grâce à la réaction d’un mutant cystéine de la protéine NikA avec une fonction maléimide, par exemple. Une autre option consiste à utiliser deux types de CLEC en mélange, chacun contenant un site réactionnel dédié à l’une des réactions visées (ici des complexes de Fe et VO).