Depuis longtemps la superoxyde dismutase (SOD), était considérée comme la seule enzyme capable d'éliminer les ions superoxydes toxiques pour la cellule. Récemment, des chercheurs de notre institut (actuellement du laboratoire Chimie et Biologie des Métaux) ont découvert une nouvelle enzyme, la superoxyde réductase (SOR), également capable d'éliminer le superoxyde mais qui procède selon un mécanisme complètement différent.
Le site actif de cette dernière est particulier et comprend un atome de fer en milieu aqueux coordonné avec quatre résidus histidine et un résidu cystéine. L'ion superoxyde O2•- se lie à cet atome de fer et réduit très efficacement l'ion superoxyde en H2O2. A proximité du site actif, la présence d'un acide aminé conservé de type lysine laissait supposer que ce dernier jouait un rôle électrostatique important dans la réactivité de l'enzyme en attirant l'anion superoxyde.
Par ailleurs, les événements de protonation sont connus pour jouer un rôle crucial dans l'élimination des ions superoxydes par la SOR. En effet, deux protons sont nécessaires à la formation de H2O2 à partir de O2•-. Les chercheurs ont pu montrer que le cycle catalytique de la SOR impliquait une base (B-) sous sa forme protonée, soit BH. L'utilisation de la spectroscopie Raman de résonance leur a permis d'étudier l'influence du pH au niveau du site actif de la SOR. Ainsi, la base servant de ligand a été identifiée chez Desulfoarculus baarsii au niveau du site actif de la SOR et s'est révélée être l'ion hydroxyde HO- dont la forme protonnée n'était autre que de l'eau, H2O.
Ainsi, bien que le ligand HO- ait été trouvé comme interagissant avec le résidu lysine conservé, ces études révèlent que les protons impliqués dans l'élimination du superoxyde sont directement fourni par l'eau du milieu au site actif et non par un acide aminé de la protéine. Ces résultats sont essentiels afin de mieux comprendre comment la cellule lutte contre le stress oxydant par une élimination efficace des espèces superoxydes toxiques.
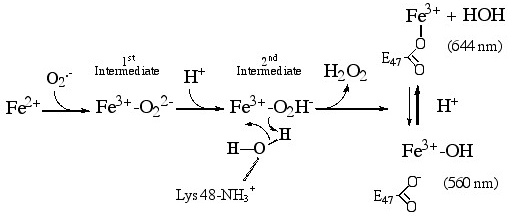
Mécanisme proposé de la Superoxyde Réductase de Desulfoarculus baarsii.
Une molécule d'eau du site actif de l'enzyme protone le second intermédiaire réactionnel (une espèce fer-hydroperoxyde). Ce processus de protonation est essentiel pour la formation et le relargage du produit final de la réaction, le peroxyde d'hydrogène H2O2.