 Réactivité des doigts de zinc : stress oxydant et stress métallique
Réactivité des doigts de zinc : stress oxydant et stress métallique
Notre premier axe de recherches visent à mieux connaître les propriétés des sites métalliques au sein des protéines et, plus particulièrement, celles des doigts de zinc. Les doigts de zinc sont de petits domaines protéiques où un ion Zn
2+ est lié, en géométrie tétraédrique par quatre chaînes latérales d'acides aminés cystéines ou histidines. Ces sites ont pour formule générale Zn(Cys)
4-x(His)
x (x=0, 1, 2). Les protéines à doigts de zinc sont ubiquitaires en biologie. A titre d'exemple, elles représentent environ 8% du protéome humain. La plupart des doigts de zinc ont un rôle structurant pour la protéine. Cependant ils peuvent réagir avec des électrophiles et certaines protéines utilisent cette propriété à des fins catalytiques. C'est le cas de la protéine de réparation de l'ADN ADA ou des farnésyl transférases. Ces protéines catalysent le transfert de groupements alkyles sur un atome de soufre de cystéine. Plus récemment, il a été proposé que des sites doigts de zinc puissent agir comme des interrupteurs rédox pour la détection et la signalisation d'espèces réactives de l'oxygène qui s'accumulent en cas de stress oxydant. Notre but est de comprendre les propriétés des sites doigts de zinc en particulier, mais aussi d'autres sites métalliques de protéines. Pour cela, nous utilisons de petits peptides modèles. Ces métallopeptides nous permettent de faire des études très fines au niveau moléculaire qui ne seraient pas possibles avec des protéines entières.

 Conception de nouveaux modèles de doigts de zinc avec divers repliements
Conception de nouveaux modèles de doigts de zinc avec divers repliements
Les doigts de zinc sont généralement des domaines protéiques de 40 à 70 acides aminés. La plupart des doigts de zinc peuvent être classés dans un nombre limité de familles structurales dont les plus importantes sont les doigts de zinc « treble clef », « zinc ribbon », « ßßα classique » et « zinc necklace ». A l'exception des doigts de zinc « ßßα classiques », il n'est pas possible d'utiliser des peptides linéaires courts pour reproduire le repliement d'un doigt de zinc. Nous avons montré que des peptides cycliques incorporant un bras linéaire (PCBL) d'une vingtaine d'acides aminés permettent de reproduire quasi-parfaitement la structure des principales familles de doigts de zinc (
Figure 1). Nous avons montré que ces peptides modèles qui reproduisent le repliement d'un site doigt de zinc en reproduisent aussi la réactivité. De plus, les complexes formés avec ces peptides sont très stables et très robustes : ils résistent à des conditions (pH élevé, forte concentration, température élevée) dans lesquelles des protéines naturelles ne sont pas forcément stables, ce qui rend l'étude des phénomènes moléculaires qui nous intéressent plus facile.
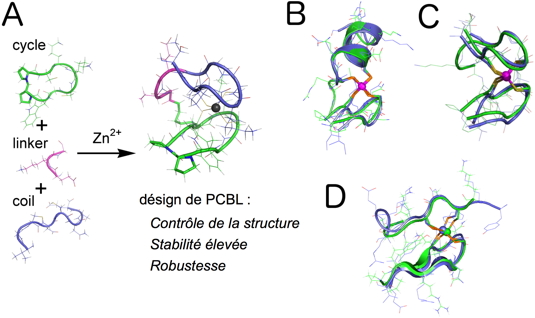 Figure 1 : (A) Schéma de la conception des modèles basés sur les PCBL. (B, C et D): Exemples de structures RMN en solution de modèles de doigts de zinc basés sur les PCBL (en vert) superposés aux structures cristallographiques des sites qu'ils miment. (en bleu, B = treble clef, C = zinc ribbon and D = loosened zinc ribbon).
RÉFÉRENCES
Sénèque O, Bourles E, Lebrun V, Bonnet E, Dumy P and Latour JM. Cyclic peptides bearing a side-chain tail: A tool to model the structure and reactivity of protein zinc sites. Angewandte Chemie International Edition, 2008
Figure 1 : (A) Schéma de la conception des modèles basés sur les PCBL. (B, C et D): Exemples de structures RMN en solution de modèles de doigts de zinc basés sur les PCBL (en vert) superposés aux structures cristallographiques des sites qu'ils miment. (en bleu, B = treble clef, C = zinc ribbon and D = loosened zinc ribbon).
RÉFÉRENCES
Sénèque O, Bourles E, Lebrun V, Bonnet E, Dumy P and Latour JM. Cyclic peptides bearing a side-chain tail: A tool to model the structure and reactivity of protein zinc sites. Angewandte Chemie International Edition, 2008
Sénèque O, Bonnet E, Joumas FL and Latour JM. Cooperative metal binding and helical folding in model peptides of treble-clef zinc fingers. Chemistry-A European Journal, 2009
Jacques A, Mettra B, Lebrun V, Latour JM and Sénèque O. On the design of zinc-finger models with cyclic peptides bearing a linear tail. Chemistry–A European Journal, 2013

 Réactivité des doigts de zinc vis-à-vis des espèces réactives de l'oxygène
Réactivité des doigts de zinc vis-à-vis des espèces réactives de l'oxygène
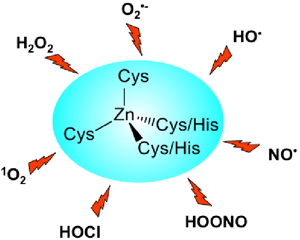 | |
Figure 2 : Espèces réactives de l'oxygène et de l'azote pouvant endommager les doigts de zinc in vivo. | |
Il a été proposé que plusieurs protéines impliquées dans les défenses cellulaires contre le stress oxydant, comme Hsp33, RsrA ou ChrR, détectent des espèces réactives de l'oxygène grâce à un site doigt de zinc qui agit comme un interrupteur rédox. Nous étudions la réactivité de modèles des doigts de zinc vis-à-vis des espèces réactives de l'oxygène et de l'azote ( Figure 2). |
 Peroxyde d’hydrogène H2O2
Peroxyde d’hydrogène H2O2
|  |
|
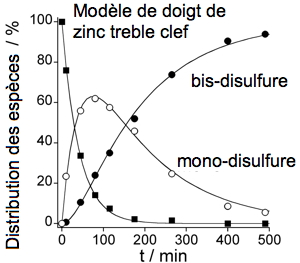
Figure 3 : Étude cinétique de la réaction d'un PCBL modèle de doigt de zinc « treble clef » avec H2O2. |
| |
Dans le but d'avoir de informations mécanistiques concernant cette réactivité, nous identifions les produits de réaction ainsi que les éventuels intermédiaires grâce à des techniques de chromatographie HPLC et de spectrométrie de masse et nous mesurons les constantes cinétiques des réactions (
Figure 3). Nous nous sommes d'abord focalisés sur la réactivité vis-à-vis de H
2O
2. Nos résultats ont montré que l'oxydation des doigts de zinc par H
2O
2 est très lente avec des temps de demi-vie pour les doigts de zinc allant de plusieurs heures à plusieurs jours pour des concentrations en H
2O
2 correspondant à un stress sévère. Cela montre que les doigts de zinc ne sont pas des cibles de H
2O
2 et ne peuvent pas être utilisés par la cellule pour détecter cet oxydant. Toutefois, cette étude a révélé que la réactivité nucléophile des doigts de zinc est principalement dictée par le nombre de cystéines liées au zinc mais qu'elle est fortement modulée par la mobilité conformationnelle des doigts de zinc : plus la dynamique conformationnelle du doigt de zinc est importante et plus celui-ci réagit vite.
RÉFÉRENCES
Bourles E, Isaac M, Lebrun C, Latour JM and Sénèque O. Oxidation of Zn(Cys)4 zinc finger peptides by O2 and H2O2: Products, mechanism and kinetics. Chemistry–A European Journal, 2011
Isaac M, Latour JM and Sénèque O. Nucleophilic reactivity of Zinc-bound thiolates: Subtle interplay between coordination set and conformational flexibility. Chemical Science, 2012
 Acide hypochloreux HOCl
Acide hypochloreux HOCl
L’acide hypochloreux (HOCl) est produit au sein des macrophages chez les mammifères afin de détruire des bactéries. Pour se défendre, certaines bactéries utilisent des protéines capables de détecter HOCl, comme par exemple la protéine Hsp33. S’il avait été montré ses dernières années que Hsp33 reconnaît HOCl par l’oxydation de son doigts de zinc Zn(Cys)
4, aucune donnée cinétique n’était disponible pour caractériser cette réaction. Nous avons utilisé un PCBL modèle du site d’Hsp33 pour mesurer la vitesse de réaction de ce site avec HOCl et nous avons montré que cette réaction était très rapide, sa constante de vitesse approchant la limite de diffusion. Au final, le site de Hsp33 réagit plus vite avec HOCl que la méthionine ou la cystéine, les deux acides aminés les plus réactifs. Ceci appuie le fait qu’Hsp33 joue le rôle de détecteur de HOCl chez certaines bactéries.
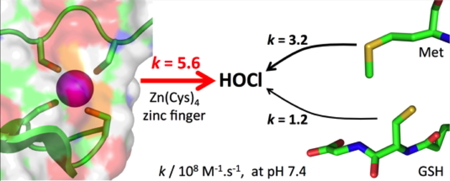 Figure 4 : Réactivité vis-à-vis de HOCl : doigt de zinc Zn(Cys)4 vs methionine ou glutathion.
RÉFÉRENCE
Lebrun V, Ravanat JL, Latour JM and Sénèque O. Near diffusion-controlled reaction of a Zn(Cys)4 zinc finger with hypochlorous acid. Chemical Science, 2016
Figure 4 : Réactivité vis-à-vis de HOCl : doigt de zinc Zn(Cys)4 vs methionine ou glutathion.
RÉFÉRENCE
Lebrun V, Ravanat JL, Latour JM and Sénèque O. Near diffusion-controlled reaction of a Zn(Cys)4 zinc finger with hypochlorous acid. Chemical Science, 2016
 Oxygène singulet 1O2
Oxygène singulet 1O2
L’oxygène singulet (
1O
2) est un autre oxydant très puissant produit par les macrophages. Nous avons montré que le site Zn(Cys)
4 du PCBL « clé de sol » réagit de manière très efficace avec
1O
2. Cette réaction conduit à la transformation des thiolates (RS–) de cystéines liées au zinc en sulfinate (RSOO–). Ceci déstabilise suffisamment le site doigt de zinc pour que le site oxydé perde l’ion Zn
2+ (l’affinité diminue de 5 ordres de grandeurs du fait de la formation d’un sulfinate) et se déstructure en conditions physiologiques. Ainsi,
1O
2 est capable de détruire des sites Zn(Cys)
4. Nous avons également montré qu’un site Zn(Cys)
2(His)
2 de doigt de zinc classique était beaucoup moins réactif vis-à-vis de
1O
2.
Lire :
L’oxygène singulet déstabilise les doigts de zinc.
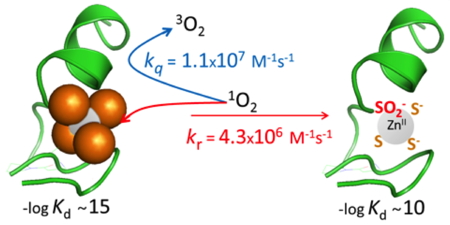 Figure 5 : Réaction d’un doigt de zinc Zn(Cys)4 « clé de sol » avec l’oxygène singulet.
RÉFÉRENCES
Lebrun V, Tron A, Scarpantonio L, Lebrun C, Ravanat JL, Latour JM, McClenaghan ND and Sénèque O. Efficient oxidation and destabilization of Zn(Cys)4 zinc fingers by singlet oxygen. Angewandte Chemie-International Edition, 2014
Figure 5 : Réaction d’un doigt de zinc Zn(Cys)4 « clé de sol » avec l’oxygène singulet.
RÉFÉRENCES
Lebrun V, Tron A, Scarpantonio L, Lebrun C, Ravanat JL, Latour JM, McClenaghan ND and Sénèque O. Efficient oxidation and destabilization of Zn(Cys)4 zinc fingers by singlet oxygen. Angewandte Chemie-International Edition, 2014
Lebrun V, Tron A, Lebrun C, Latour JM, McClenaghan ND and Sénèque O. Reactivity of a Zn(Cys)2 (His)2 zinc finger with singlet oxygen: Oxidation directed toward cysteines but not histidines. Chemistry - A European Journal, 2015
Chabert V, Lebrun V, Lebrun C, Latour JM and Sénèque O. Model peptide for anti-sigma factor domain HHCC zinc fingers: High reactivity toward 1O2 leads to domain unfolding. Chemical Science, 2019

 Réactivité des doigts de zinc vis-à-vis de complexes et d’ion métalliques
Réactivité des doigts de zinc vis-à-vis de complexes et d’ion métalliques
Les sels d’or ont une grande affinité pour les thiols et peuvent donc potentiellement interagir avec toute protéine qui en contient. Les sels d’or(I) sont utilisés depuis de nombreuses années à des fins thérapeutiques, comme pour le traitement de la polyarthrite rhumatoïde, et les sels d’or(III) présentent des activités anticancéreuses très prometteuses. Cependant, leur mode d’action reste encore inconnu. Une des hypothèses les plus sérieuses pour leur mode d’action serait une interaction avec les doigts de zinc de certaines protéines. Nous avons entrepris de caractériser l’interaction des sels d’or avec nos modèles.
Le complexe Au
IIIterpy (terpy = terpyridine) réagit très vite (k ≈ 10
5 M
-1 s
-1) avec un doigt de zinc ZnCys
4 de type zinc ribbon pour former un complexe présentant un pont disulfure et une entité S–Au
I–S. Ceci montre qu’un sel d’or(III) peut détruire très rapidement un doigt de zinc. La réaction en présence d’un excès de thiol libre mimant le glutathion des cellules, conduit à l’éjection du zinc et à la formation d’un complexe avec deux entités S–Au
I–S au sein du peptide. La destruction d’un doigt de zinc ZnCys
4 par des complexes d’or(III) et même d’or(I) en milieu cellulaire est donc possible.
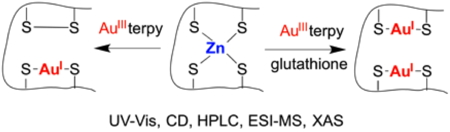 Figure 6 : Réactivité d’un site Zn(Cys)4 « Zinc Ribbon » avec un complexe d’or(III).
RÉFÉRENCE
Jacques A, Lebrun C, Casini A, Kieffer I, Proux O, Latour JM and Sénèque O. Reactivity of Cys4 Zinc finger domains with Gold(III) complexes: Insights into the formation of "gold fingers". Inorganic Chemistry, 2015
Figure 6 : Réactivité d’un site Zn(Cys)4 « Zinc Ribbon » avec un complexe d’or(III).
RÉFÉRENCE
Jacques A, Lebrun C, Casini A, Kieffer I, Proux O, Latour JM and Sénèque O. Reactivity of Cys4 Zinc finger domains with Gold(III) complexes: Insights into the formation of "gold fingers". Inorganic Chemistry, 2015
 Modèles de protéines à fer
Modèles de protéines à fer
Notre PCBL modèle de doigt de zinc « zinc ribbon » (L
ZR) forme des complexes stables avec Fe
2+ et Fe
3+ dans l'eau à pH 7. Ces complexes reproduisent toutes les propriétés spectroscopiques des formes réduites et oxydées de la rubrédoxine, une protéine de transfert d'électrons qui présente un site Fe(Cys)
4. FeL
ZR a un potentiel rédox de +144 mV / ENH et est capable de cycler entre les états Fe
2+ et Fe
3+ comme la rubrédoxine (
Figure 7). Ce complexe constitue le modèle de rubrédoxine le plus stable connu à ce jour avec un si faible nombre d'acides aminés. Les propriétés de ce complexe démontrent qu'il est possible d'implémenter des fonctionnalités rédox dans les métallopeptides basés sur les PCBL grâce à leur robustesse.
Lire :
Modèles peptidiques et protéines doigts de zinc.
 Figure 7 : (A et B) Spectres d'absorption UV-Vis (A) et CD (B) des complexes FeIILZR et FeIIILZR. (C) Cyclage rédox de FeLZR suivi par l'absorbance à 491 nm.
RÉFÉRENCES
Jacques A, Clémancey M, Blondin G, Fourmond V, Latour JM and Sénèque O. A cyclic peptide-based redox-active model of rubredoxin. Chemical Communications (Camb), 2013
Figure 7 : (A et B) Spectres d'absorption UV-Vis (A) et CD (B) des complexes FeIILZR et FeIIILZR. (C) Cyclage rédox de FeLZR suivi par l'absorbance à 491 nm.
RÉFÉRENCES
Jacques A, Clémancey M, Blondin G, Fourmond V, Latour JM and Sénèque O. A cyclic peptide-based redox-active model of rubredoxin. Chemical Communications (Camb), 2013
Jacques A, Latour JM and Sénèque O. Peptide-based FeS4 complexes: The zinc ribbon fold is unsurpassed to stabilize both the FeII and FeIII states. Dalton Transactions, 2014
 Sondes luminescentes et agents de contrastes
Sondes luminescentes et agents de contrastes
En nous basant sur notre connaissance de la conception, de la synthèse et de la chimie de coordination des doigts de zinc, nous avons lancé un programme de recherche qui vise à développer des sondes peptidiques pour la détection de cations métalliques ou de biomolécules dans les milieux biologiques. Ces sondes sont construites à partir d’un peptide inspiré d’un domaine de reconnaissance protéique (site métallique ou site de liaison d’une biomolécule) pour la reconnaissance moléculaire et elles utilisent des lanthanides pour leurs propriétés de luminescence ou de magnétisme afin de signaler la présence de leur cible.

 Sondes pour la détection de Zn2+
Sondes pour la détection de Zn2+
Pour développer des sondes à zinc, nous avons choisi d’utiliser des protéines à doigts de zinc classiques comme unité de reconnaissance. Ces protéines lient le zinc avec une forte affinité et sont sélectives du zinc par rapport aux autres cations physiologiques. En les fonctionnalisant par un complexe de lanthanide et son antenne sensibilisatrice, tous deux judicieusement disposés au sein du peptide, nous avons obtenu une famille de sondes sélectives du zinc avec des émissions allant du visible (avec les lanthanides terbium et europium) au proche infrarouge (avec le néodyme), domaine spectrale très intéressant pour l’analyse en milieu biologique.
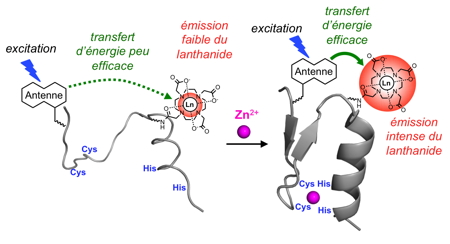 Figure 8 : Principe de détection du zinc par un doigt de zinc luminescent.
RÉFÉRENCES
Cepeda C, Raibaut L, Fremy G, Eliseeva SV, Romieu Z, Pecaut J, Boturyn D, Petoud S and Sénèque O. Using native chemical ligation for site-specific synthesis of hetero-bis-lanthanide peptide conjugates: Application to ratiometric visible or near-infrared detection of Zn2+, Chemistry A European Journal, 2020
Figure 8 : Principe de détection du zinc par un doigt de zinc luminescent.
RÉFÉRENCES
Cepeda C, Raibaut L, Fremy G, Eliseeva SV, Romieu Z, Pecaut J, Boturyn D, Petoud S and Sénèque O. Using native chemical ligation for site-specific synthesis of hetero-bis-lanthanide peptide conjugates: Application to ratiometric visible or near-infrared detection of Zn2+, Chemistry A European Journal, 2020
Fremy G, Raibaut L, Cepeda C, Sanson M, Boujut M and Sénèque O. A novel DOTA-like building block with a picolinate arm for the synthesis of lanthanide complex-peptide conjugates with improved luminescence properties, Journal of Inorganic Biochemistry, 2020
Isaac M, Pallier A, Szeremeta F, Bayle PA, Barantin L, Bonnet CS and Sénèque O.
MRI and luminescence detection of Zn2+ with a lanthanide complex-zinc finger peptide conjugate.
Chemical Communications (Camb), 2018
Isaac M, Raibaut L, Cepeda C, Roux A, Boturyn D, Eliseeva SV, Petoud S and Sénèque O. Luminescent zinc fingers: Zn-responsive neodymium near-infrared emission in water. Chemistry-a European Journal, 2017

 Sondes pour la détection de Cu+
Sondes pour la détection de Cu+
Nous avons également développé une sonde pour Cu
+ inspirée du site de liaison du cuivre de la protéine CusF qui présente notamment une interaction cation/π entre un acide aminé tryptophane et l’ion Cu
+. Cette sonde parfaitement sélective de Cu
+ fonctionne grâce à une modulation tout à fait originale des propriétés de l’antenne sensibilisatrice d’un ion Tb
3+ par le biais de l'interaction cation/π.
Lire :
Détection du cuivre par luminescence.
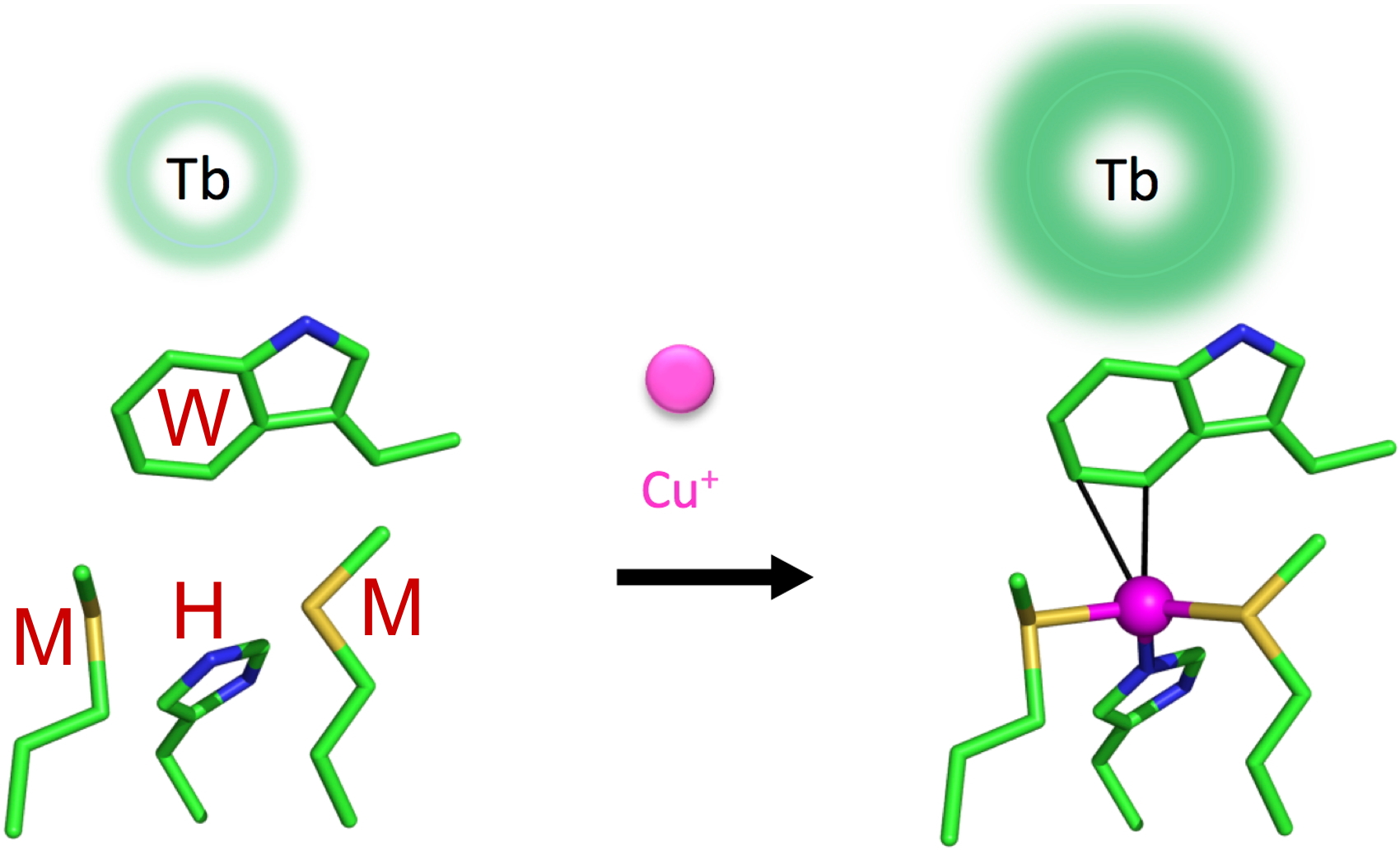 Figure 9 : Une sonde luminescente bio-inpirée pour la détection de Cu+.
RÉFÉRENCES
Isaac M, Denisov SA, McClenaghan ND and Sénèque O. Bioinspired luminescent Europium-based probe capable of discrimination between Ag+ and Cu+. Inorganic Chemistry, 2021
Figure 9 : Une sonde luminescente bio-inpirée pour la détection de Cu+.
RÉFÉRENCES
Isaac M, Denisov SA, McClenaghan ND and Sénèque O. Bioinspired luminescent Europium-based probe capable of discrimination between Ag+ and Cu+. Inorganic Chemistry, 2021
Cepeda C, Denisov SA, Boturyn D, McClenaghan ND and Sénèque O. Ratiometric luminescence detection of Copper(I) by a resonant system comprising two antenna/lanthanide pairs. Inorganic Chemistry, 2021
Roux A, Isaac M, Chabert V, Denisov SA, McClenaghan ND and Seneque O. Influence of amino acid sequence in a peptidic Cu(+)-responsive luminescent probe inspired by the copper chaperone CusF. Organic and Biomolecular Chemistry, 2018
Isaac M, Denisov SA, Roux A, Imbert D, Jonusauskas G, McClenaghan ND and Sénèque O. Lanthanide luminescence modulation by cation-pi interaction in a bioinspired scaffold: Selective detection of copper(I). Angewandte Chemie - International Edition, 2015

 Sondes pour la détection d’une courte séquence d’ARN messager
Sondes pour la détection d’une courte séquence d’ARN messager
Nous avons conçu une sonde luminescente pour la séquence UUAUUUAUU d’ARN messager en utilisant le domaine de liaison de cette séquence au sein de la protéine tristetraproline. Ce domaine de 68 acides aminés a été synthétisé chimiquement par assemblage de trois fragments par ligation native. Un fragment incorpore un complexe de terbium et un autre son antenne sensibilisatrice. Nous avons montré que ce design permet d’obtenir une sonde luminescente s’allumant en présence de la séquence d’ARN cible et qu’elle conserve toutes les propriétés de liaison du domaine de reconnaissance de la tritetraproline (affinité, sélectivité, cinétiques de liaison et dissociation rapides), en faisant un système très prometteur en vue de futures applications
in vivo.
Lire :
Conception de sondes luminescentes.
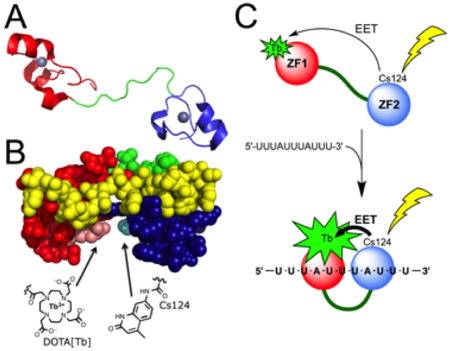 Figure 10 : Principe de détection d’un ARN messager à l’aide d’une protéine luminescente synthétique.
RÉFÉRENCE
Raibaut L, Vasseur W, Shimberg GD, Saint-Pierre C, Ravanat JL, Michel SLJ and Sénèque O. Design of a synthetic luminescent probe from a biomolecule binding domain: Selective detection of AU-rich mRNA sequences. Chemical Science, 2017
Figure 10 : Principe de détection d’un ARN messager à l’aide d’une protéine luminescente synthétique.
RÉFÉRENCE
Raibaut L, Vasseur W, Shimberg GD, Saint-Pierre C, Ravanat JL, Michel SLJ and Sénèque O. Design of a synthetic luminescent probe from a biomolecule binding domain: Selective detection of AU-rich mRNA sequences. Chemical Science, 2017